디젤 엔진 공회전조건에서 Cu-zeolite SCR 촉매의 오존 분사에 따른 NOx 거동 및 환원 메케니즘에 관한 연구
Copyright Ⓒ 2024 KSAE / 222-03
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium provided the original work is properly cited.
Abstract
The effect of the ozone supply to the SCR catalyst was investigated to reduce NOx emissions under low-temperature conditions in diesel engines. These experiments were done at an idling condition, in which the exhaust gas temperature was less than 100 oC. In this study, it is found that when ozone is supplied, NO is oxidized to NO2 or HNO3, and these are adsorbed as a form of NO3 on the catalyst. When NH3 and ozone are supplied together, NO2 or HNO3 generated by ozone react with NH3 to form NH4NO3. The NH4NO3 generated in this way is converted to N2 and H2O under an SCR suitable condition of NO supply and rising temperature. It means that the supply of ozone can improve the performance of NO reduction to a certain extent under low-temperature conditions where an SCR reaction does not normally occur.
Keywords:
NOx, Selective catalytic reaction, Cu zeolite catalyst, Ozone injection, Diesel engine키워드:
질소산화물, 선택적 환원촉매, 구리 제올라이트 촉매, 오존 분사, 디젤 엔진1. 서 론
2000년대 이후 디젤 자동차에 SCR(Selective Catalytic Reaction) 기술이 사용되면서 디젤 자동차에서 배출되는 NOx양은 매우 감소하였다.1,2) 특히, 2010년 이후 높은 정화 효율과 열적 안정성을 갖는 Cu-zeolite 촉매가 소개되어 사용되었고, SCR 촉매의 반응 메케니즘이 심도 있게 연구되는 등 SCR 기술은 지속해서 발전해 왔다.3-5) 최근 SCR 촉매를 부착한 디젤 자동차는 배출가스 온도가 높은 조건에서는 NOx를 거의 완벽히 정화한다. 하지만 배출가스 온도가 낮은 조건에서는 여전히 많은 양의 NOx가 배출되고, 이는 대기오염에 큰 영향을 미치고 있다. 향후 디젤 자동차의 저온 배출 NOx에 대한 배출허용기준은 더욱 강화될 그것으로 예상하며, 저온 배출 NOx 저감 기술 개발이 필요한 상황이다.6) 버너를 이용해 배출가스 온도를 높이고, 요소수 대신에 암모니아 가스를 공급하는 등 저온에서 배출되는 NOx를 저감하기 위해 다양한 기술이7,8)이 소개되고 있으나 여러 가지 단점이 존재하여 이 문제가 완벽히 해결된 상황은 아니다.
오존을 배출가스 중에 분사하면 저온에서 NO가 산화되어 NO2가 생성된다. 배출가스 중에 NO만 존재하는 것보다 NO와 NO2가 함께 존재하는 것이 SCR의 NOx 저감 효율 향상에 유리하다는 것은 널리 알려진 사실이다.9-11) 물론, 배출가스 중의 NO를 NO2로 전환하기 위하여 DOC(Diesel Oxidation Catalyst)를 이용할 수도 있지만, 이 방법은 DOC가 활성화되는 배출가스 온도와 관계가 있기 때문에 배출가스 온도가 약 200 oC 미만의 저온에서는 적용할 수 없다.
오존을 이용하여 NO의 산화 특성을 고찰한 선행 연구는 다수 존재한다. 이 선행 연구들에 의하면 오존을 분사하였을 때 촉매가 없는 상온 조건에서도 NO가 NO2로 빠르게 전환된다.12-16) 그리고, 오존 공급량이 적어서 O3/NO 몰 비율이 낮을 때(< 1)에는 NO2를 생성하고, 더 높은 O3/NO 몰 비율(> 1) 조건에서는 주로 NO3, N2O5 등이 생성된다.17)
오존을 이용한 배출가스 저감에 관한 연구는 오존으로 습식 스크러버의 NOx 수용성을 높이는 연구18) 와 SCR 촉매로 유입되는 배출가스 중의 NO와 NO2 비율을 1:1로 만들어 Fast SCR 조건을 유도함으로써 NOx 저감률을 높이고자 하는 연구12,19)의 두 종류가 존재한다. Qian 등은12) Cu-CHA zeolite 촉매 시료에 NH3를 흡착시킨 후 NO와 오존을 함께 공급하는 실험을 하였으며, IR(Infra-Red) 분석기를 이용하여 NO 등 화학종의 변화를 고찰하였다. 이 연구에서는 오존을 이용해 NO를 산화시키면 NO3 형태로 Cu-zeolite 촉매에 흡착되고, 이 NO3는 약 300 oC 이상에서 NO2 형태로 탈착되어 나오거나 암모니아와 반응하여 NH4NO3가 생성되는 현상이 관찰되었다. 그들은 이 연구를 통해서 오존을 분사하여 NOx를 NO3 형태로 촉매에 흡착시키거나 NH4NO3로 변환시키고, 고온에서 이 물질들에 대한 SCR 반응을 유도함으로써 NOx 저감 효율을 높일 수 있다고 주장하였다. 한편, Masato Nagata 등은20) LNT(Lean NOx trap) 전단에 오존을 공급하는 연구를 하였다. 그 결과 오존의 산화를 통하여 NOx 흡착률을 높이고, 이에 따라 저온 NOx 저감률이 향상되는 것을 확인하였다.
현재까지 수행된 대부분의 오존 이용 SCR 연구는 샘플 촉매와 간이반응기를 사용하여 수행되었고, 실제 디젤 엔진을 대상으로 직접 오존을 공급하여 SCR 반응을 연구한 경우는 매우 드물다. 그리고, 현재까지 디젤 엔진의 배출가스 중에 오존공급량을 변화시켜가면서 SCR 촉매 내에서 NOx의 거동이 어떻게 변화하는지에 대한 자세한 연구는 수행된 바 없다. 따라서, 본 연구는 공회전조건에서 운전되는 디젤 엔진의 배출가스 중에 오존과 NH3를 공급하였을 때 Cu-zeolite SCR 촉매 내에서의 NOx 거동 변화를 파악하고, 저온 NOx 저감 성능 개선에 대한 가능성을 고찰하는 것을 목표로 한다.
2. 실험장치 및 방법
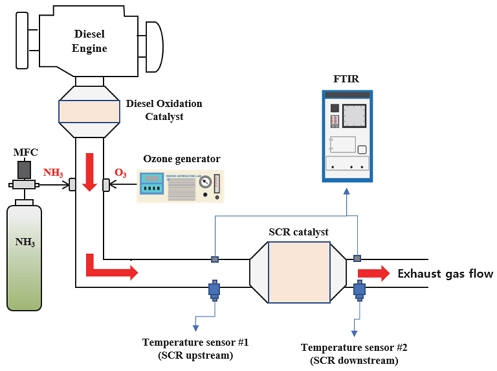
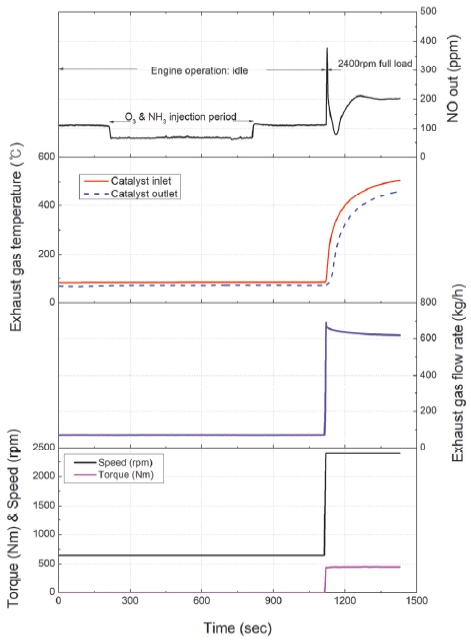
본 연구에서 사용한 실험장치의 개략도는 Fig. 1과 같다. 디젤 엔진과 DOC와 SCR 촉매로 구성된 배기 후 처리시스템, 오존 발생 장치, NH3 공급장치, 배출가스 측정 장비로 구성된다. 본 연구에서 사용된 디젤 엔진은 Euro-4 배출허용기준을 만족하는 4행정 4기통 디젤 엔진으로 주요 제원은 Table 1에 나타내었다. 실험에 사용된 SCR 촉매는 연구에 사용된 엔진의 차량에 장착된 상용 Cu-zeolite 촉매로 제원은 Table 2와 같다. 배기관에 오존과 NH3를 분사하였으며, 오존공급을 위해서 최대 300 W 전력으로 33.6 g/h의 오존을 공급할 수 있는 오존 생성기(오존텍, LAB-1)를 2대 병렬로 사용하였다. 따라서 본 연구에서 오존 생성을 위해 600 W의 전기가 공급되었다는 것은 오존 생성기 2대를 최대부하로 사용했다는 것을 의미한다.
NH3는 NH3가 담긴 고압 실린더로부터 직접 공급하였다. NH3는 NOx와 1:1에 근사한 비율로 공급되었다. 배출가스와 NH3는 AVL 사의 FTIR(AVL SESAM i60)을 이용하여 측정하였다. FTIR 장치는 측정 채널이 하나로 한 지점의 배출가스 성분만을 측정할 수 있으므로 SCR 전⋅후단의 배출가스 성분 측정이 필요할 경우 전단을 측정한 후 샘플링 프로브를 이동시켜 후단을 측정하는 방식을 취하였다. SCR 촉매 전⋅후단의 온도는 K-type 열전대를 이용하여 측정하였다.
Fig. 2는 SCR 촉매 전단에 오존을 분사했을 때 NOx의 거동을 알아보기 위한 실험 절차를 나타낸다. 이 실험은 엔진 공회전조건에서 수행되었다. 실험 시작 후 약 180초 지난 후 SCR 전단에 오존 분사를 시작하고, 오존 분사 시작 시점에서 600초가 지난 후에 오존 분사를 중지하였다. 오존 분사 시에는 오존 생성기의 전기공급량을 변화시켜 해당 실험에서 필요한 양의 오존이 배기관에 공급되도록 하였다. Table 3은 엔진이 공회전 상태일 때 오존 생성기의 전력에 따른 오존 발생량과 이때의 O3/NO 몰비(Molar ratio)를 나타내었다. 참고로 이 연구에서 언급되는 O3/NO 몰비는 오존이 분사되지 않는 조건에서 SCR 촉매 전단에서 배출되는 NO에 대한 오존의 몰비를 나타낸다.
Experimental procedure of this study (O3 & NH3 injection event & engine operation condition are described.)

O3 amount and O3/NO molar ratio with respect to power of O3 generator at the condition of engine idle
필요시 오존이 분사되는 기간에 NH3를 같이 공급하여 SCR에서의 NOx 거동을 관찰하였다. 오존과 NH3 공급이 중단된 후 300초 동안 엔진 공회전 상태를 유지한 후에 2,400 rpm 전부하조건으로 엔진 운전조건을 변화시켰다. 공회전조건에서 전부하조건으로 변화하는데 걸리는 시간은 10초였다. 2,400 rpm 전부하조건은 약 300초 운전하여 촉매 온도가 충분히 상승하고, 촉매에 흡착되어 있던 NOx 및 NH3가 충분히 탈착되거나 반응될 수 있도록 하였다.
3. 결과 및 고찰
3.1 오존 분사에 따른 SCR 촉매 전단에서의 NOx 거동
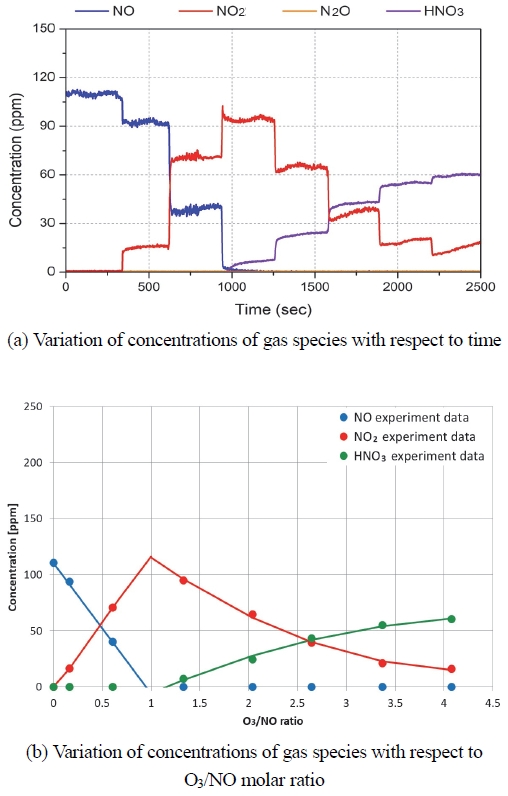
Fig. 3은 오존공급량에 따른 배출가스 중의 NO, NO2, HNO3, NH3의 농도 변화를 나타낸다. SCR 전단에서 측정된 배출가스 농도이며, 오존 분사 지점으로부터 배출가스 측정 위치까지는 약 1 m 떨어져 있고, 그 사이에는 아무것도 존재하지 않는다. Fig. 3(a)은 실시간 데이터이며, Fig. 3(b)은 실시간 데이터를 평균하여 구한 데이터이다. O3/NOinlet 몰 비율이 ‘1’까지는 오존 공급량이 증가함에 따라 NO가 감소하고, NO2가 증가한다. O3/NOinlet 몰 비율이 1보다 클 경우 NO2는 감소하며 HNO3가 증가하는 것을 알 수 있다. 선행 연구12,15)에서는 오존에 의해 NO가 산화되어 NO2, NO3, HNO3, N2O5가 생성되는 화학반응 메케니즘을 반응식 (R1) ~ (R5)와 같이 제시하였으며, 본 연구의 실험 결과도 이 반응 메케니즘으로 잘 설명된다. O3/NOinlet 몰 비율이 높은 경우 (>2)에서 측정되는 질소산화물의 총 합이 NOinlet 보다 낮다. 그 이유는 측정에 사용된 FTIR이 NO2, NO3, HNO3의 질소산화물만 측정 가능하여 N2O5, NO3 등의 다른 질소산화물을 측정하지 못하기 때문으로 보인다.
| (R1) |
| (R2) |
| (R3) |
| (R4) |
| (R5) |
3.2 오존 분사에 따른 SCR 촉매 전⋅후단에서의 NOx 거동 비교
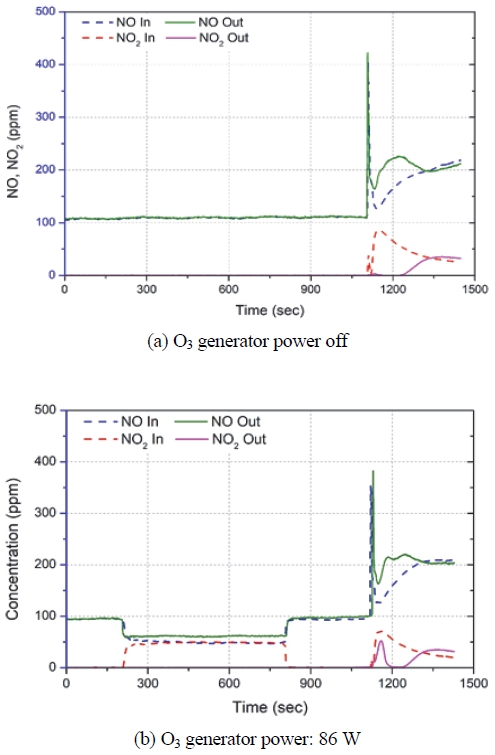
Fig. 4는 엔진 공회전조건에서 오존을 공급하지 않은 경우(Fig. 4(a))와 오존을 공급한 경우(Fig. 4(b))에 대해서 SCR 촉매 전⋅후단에서 측정한 배출가스 농도를 나타내는 그래프이다. NH3를 분사하지 않았으므로 SCR 촉매에서 NH3와 NO의 반응은 발생하지 않는다. 오존을 공급하지 않은 Fig. 4(a) 결과에 의하면 1,100초까지의 공회전조건에서는 SCR 전단 및 후단 NO의 농도는 약 105 ppm으로 일정하다. 그리고 SCR 전단 및 후단의 NO2 농도도 ‘0’으로 동일하다. 하지만 엔진 운전조건이 전부하 조건으로 전환되면 배출가스 온도가 상승하여 DOC에서 일부의 NO가 NO2로 산화되어 배출됨에 따라 SCR 전단의 NO2 농도가 상승한다. 그리고 SCR 후단에서 측정되는 NO2는 시간이 조금 흐른 후(약 1,300초)에 SCR 전단의 NO2 농도와 유사해지는데 이는 1,100초에서 1,300초 사이에서 유입되는 NO2가 촉매에 흡착되기 때문으로 보인다. 1,100초에서 1,300초 사이에 NO2가 촉매에 흡착되는 과정에서 NO의 농도는 SCR 전단보다 SCR 후단이 더 높게 측정되고 있다. 이는 NO2가 촉매에 흡착되는 과정에서 NO가 배출되는 것을 의미한다.
The effect of O3 injection on the NOx behavior in case of without NH3(Engine operating condition changed from idle to full load of 2,400 rpm at about 1,100 s)
참고문헌21)에 의하면 NO2가 유입되는 경우 Cu-zeolite 촉매 내부에서는 다음과 같은 반응이 발생한다.
| (R6) |
| (R7) |
| (R8) |
이 반응 메케니즘에 의하면 NO2는 저온에서 (R6)의 반응을 통해 촉매의 Cu2+에 화학 흡착된다. NO2가 더욱 많이 존재하는 조건에서는 (R7) 반응을 통해 Cu2+-NO3로 흡착되는데, 이 과정에서 NO가 발생하게 된다. 즉, Fig. 4(a)의 엔진 전부하조건에서 SCR 전단의 NO 농도가 SCR 후단의 NO 농도보다 높은 이유는 (R7) 반응으로 NO2가 Cu2+-NO3로 흡착되면서 NO가 발생하는 것으로 설명할 수 있다. 또한, Cu2+-NO3는 (R8) 반응에서와 같이 NO2로 탈착되기도 한다.
Fig. 4(b)는 오존을 공급한 경우 SCR 촉매 전⋅후단에서의 NO와 NO2 농도의 변화를 나타낸다. 이 실험에서는 오존공급을 위해서 오존 생성기에 86 W의 전력량을 공급하였으며, NH3는 분사하지 않았다. 오존 분사 기간(170 ~ 870s)에 SCR 전단에서 NO가 감소하고, NO2 농도는 증가한다. 이는 오존이 NO를 NO2로 산화시킨다는 것을 의미한다. 하지만 SCR 후단에서 측정되는 NO 농도는 SCR 전단의 NO 농도보다 높음을 알 수 있다. 이는 (R6) 과 (R7)의 반응으로 인해 NO가 NO3로 촉매에 흡착되면서 NO가 생성되기 때문으로 보인다. 또한, 오존 분사 기간에 SCR 후단에서 NO2는 측정이 되지 않는 것으로 보아 NO2는 전부 SCR 촉매에 흡착되는 것으로 보인다. 1,100초에 엔진 운전조건이 공회전에서 전부하조건으로 전환되는 순간에 일부의 NO2가 SCR 후단에서 측정된다. 이는 오존을 공급하지 않은 Fig. 4(a)의 경우와는 다른 결과로 (R6)의 정반응과 (R7) 반응으로 촉매에 흡착되어 있는 NO2나 NO3 중에서 약하게 결합되었던 일부 NO2나 NO3가 (R6)의 역반응과 (R8) 반응을 겪으면서 NO2의 형태로 탈착되는 것으로 보인다.
3.3 오존과 암모니아 분사 시 오존공급량에 따른 SCR 촉매 후단에서의 NOx 거동 비교
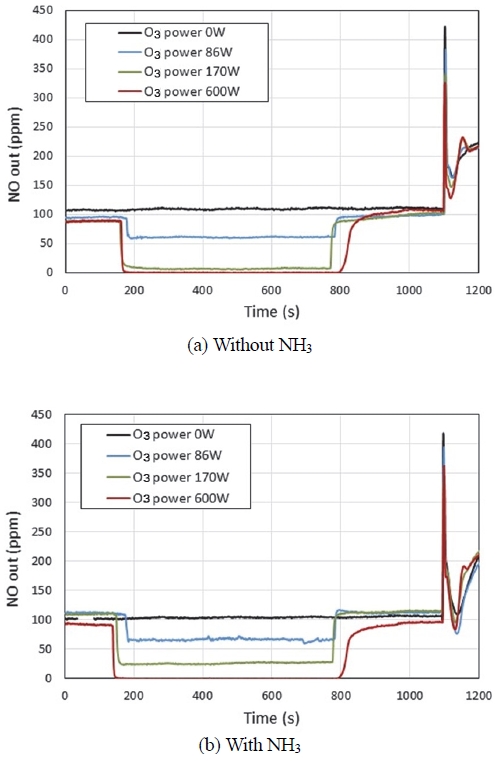
Fig. 5는 오존 공급량에 따른 NO의 거동을 알아보기 위하여 SCR 촉매 후단에서 NO 농도를 측정한 그림이다. Fig. 5(a)는 NH3를 분사하지 않고, 오존만을 공급한 경우이다. 이 실험 결과에 의하면 오존공급량이 증가함에 따라 SCR 촉매 후단에서 측정되는 NO 농도는 점차 감소한다. Fig. 5(b)는 NH3와 오존을 동시에 공급한 경우이다. Fig. 5(a)와 다른 점은 오존 생성기에 86 W와 170 W의 전력을 공급하였을 때의 SCR 후단의 NO 농도가 동일 조건의 Fig. 5(a)보다 약간씩 높다는 것이다. 이는 이미 언급한 바와 같이 (R6)과 (R7)의 반응으로 인해 NO가 NO3로 촉매에 흡착되는 과정에서 NO가 발생하기 때문으로 보인다. 하지만 오존 생성기에 600 W의 전력량을 공급하였을 때는 SCR 후단의 NO 농도가 ‘0’으로 NH3를 공급하지 않은 Fig. 5(a)와 동일하다. 오존 생성기에 600 W의 전력량을 공급하면 (R2) ~ (R5) 반응을 통해 NO는 NO2가 아닌 HNO3 형태로 SCR 촉매에 유입되기 때문에 NO2가 Cu2+-NO2와 반응하여 Cu2+-NO3로 흡착되는 과정에서 발생하는 NO는 없는 것으로 보인다.
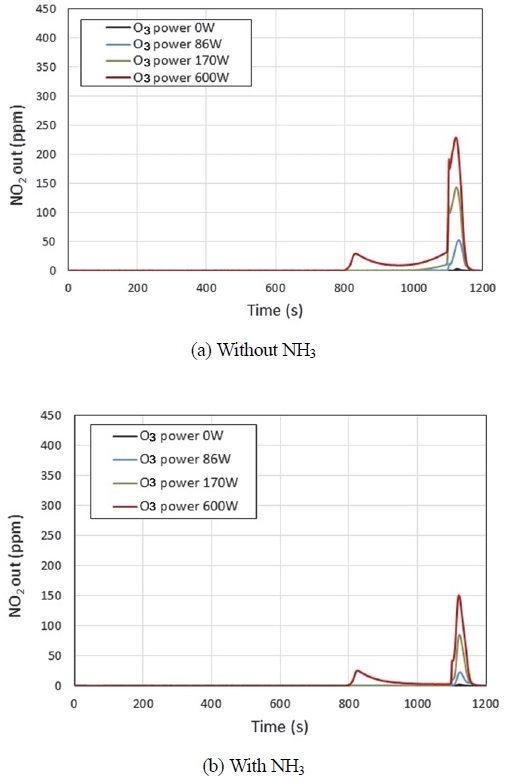
Fig. 6은 오존 분사에 따른 NO2의 거동을 알아보기 위하여 SCR 촉매 후단에서 측정한 NO2 농도를 나타낸 그림이다. Fig. 6(a)은 NH3를 분사하지 않고, 오존만을 공급한 경우이다. 이 실험 결과에 의하면 엔진 운전조건이 공회전에서 전부하로 변하여 온도가 상승하는 시점(1,100 s)에서 NO2가 탈착되어 나온다. 그리고, 오존 공급량이 많을수록 천이조건에서 탈착되는 NO2의 양도 많아진다. 이는 오존 공급량이 많을수록 더 많은 양의 NO3가 흡착되어 있다가 NO2 분자로 방출되는 것으로 보인다. 한편 오존공급량이 많은 조건(600 W)에서는 오존 분사가 중지된 후 엔진 공회전조건(800 ~ 1,100 s)에서도 NO2가 배출되는 것을 볼 수 있다. 오존공급량이 많은 조건(600 W)에서는 HNO3 형태로 SCR 촉매 전단에 유입되는데 약한 세기로 많은 양의 NO3가 흡착되어 있고, 오존 분사가 중지되어 평형상태가 깨어지면 이들이 NO2로 배출되는 것으로 보인다. 이와 같은 NO2의 저온 조건 탈착은 SCR 반응이 가능한 고온 조건에서 탈착되지 못함으로써 NOx 저감에 부정적 기여를 하게 되는 것으로 판단된다.
Fig. 6(b)은 NH3를 분사하면서 오존을 공급한 경우이다. NH3를 분사하지 않은 Fig. 6(a)과 다른 점은 SCR 후단에서 측정되는 NO2 농도가 Fig. 6(a)에 비해 적다는 것이다. NH3를 공급하지 않으면 흡착된 NO2가 몰수의 큰 변화 없이 그대로 탈착되는 반면, NH3가 공급되는 조건에서는 (R9)와 (R10)과 같이 2 mol의 NO2가 NH3와 반응하여 NH4NO3로 전환되고, (R11)과 같이 NH4NO3가 NO와 반응하여 1 mol의 NO2가 형성되기 때문에 SCR 후단에서 측정되는 NO2 농도가 적어지는 것으로 보인다. Seki 등은17) 제올라이트 촉매에 존재하는 루이스 산 점(Lewis acid site, Cu2+) 또는 브뢴스테드 산 점(Brønsted acid site, σ)에 NH3가 흡착된 후 NO2와 반응하여 NH4NO3가 생성되는 반응경로를 다음과 같이 제시하였고, 본 연구의 실험 결과를 잘 설명한다.
| (R9) |
| (R10) |
| (R11) |
| (R12) |
위 식에서 Cu2+는 Lewis 산 점으로 NH3를 배위결합 형태로 흡착한다. 그리고, σ는 Brønsted 산 점으로써 NH3를 NH4+ 형태로 흡착된다. S’는 제올라이트 촉매에서 NH4NO3가 생성되는 Site를 의미한다.
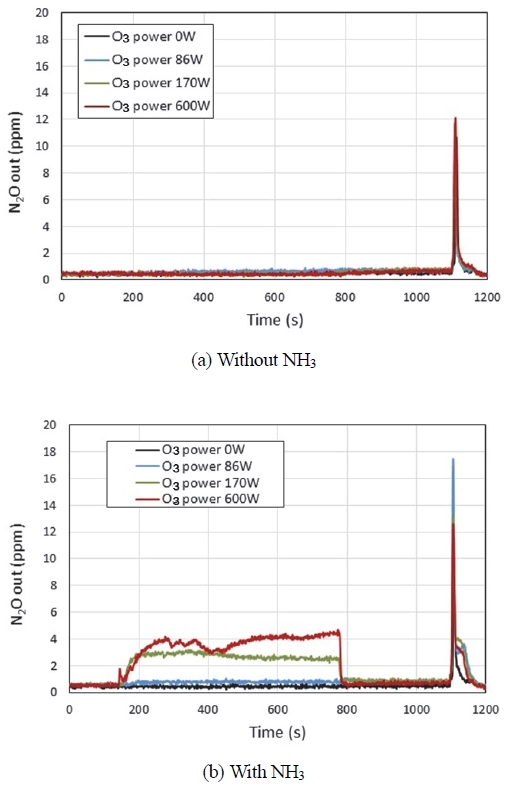
Fig. 7은 SCR 촉매 후단의 N2O 농도를 나타낸 그림이다. Fig. 7(a)은 NH3를 분사하지 않고, 오존만을 공급한 경우로서 엔진 운전조건이 공회전에서 전부하로 변화하는 천이시점에서 미량 N2O가 발생하는 것을 알 수 있다. N2O 발생량은 오존 공급량과는 무관하게 최댓값이 약 12 ppm 정도로 비슷하였고, 총발생량을 의미하는 그래프의 면적도 유사하였다. 통상 SCR 촉매에서 N2O는 NH4NO3의 열분해로 발생하는 것으로 알려져 있다. 하지만 Fig. 7(a)에서는 NH3를 공급하지 않았고, 이에 따라 NH4NO3가 생성되지 않았을 것으로 추측되므로 NH4NO3로부터 생성된 것은 아니고, 이 경우에는 엔진 연소나 DOC에서 발생하는 것으로 보인다. Fig. 7(b)은 NH3와 오존을 동시에 공급한 경우의 그림이다. 오존 공급량이 증가할수록 오존이 공급되는 구간(170 ~ 770s)에서 N2O 배출량이 많아지는 것을 알 수 있다. 이는 (R9) 및 (R10) 반응으로 생성되는 NH4NO3 양이 많아지고, NH4NO3가 (R12) 반응으로 분해되는 N2O 양이 많아진다는 것을 의미한다.
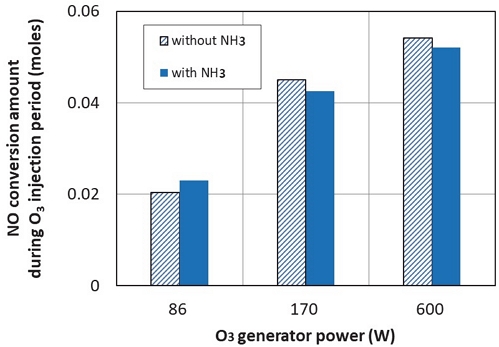
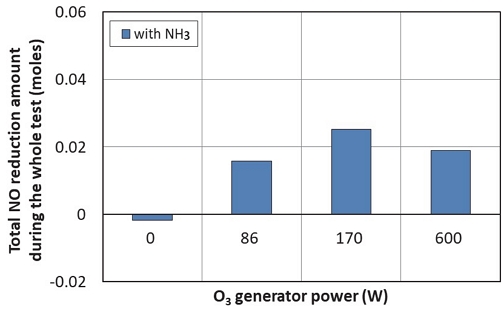
Fig. 8은 이 실험에서 오존을 분사하지 않았을 때 배출되는 NO의 양 대비 오존을 분사하는 동안 저감되는 NO의 양(몰 수)을 나타낸다. 이미 언급한 바와 같이 오존을 분사하면 오존공급량에 따라 NO가 NO2나 HNO3 등으로 전환됨에 따라 NO는 저감된다. 이에 따라 오존 생성기에 공급되는 전력량이 클수록 많은 양의 NO가 저감되는 것을 알 수 있다. 그리고, NO 저감량은 NH3 공급 여부와 관계없이 유사함 알 수 있다. 실험 결과 NH3를 공급한 경우와 공급하지 않았을 경우 NO 저감량이 완벽히 같지 않고 약간의 차이가 발생하는 이유는 매 실험이 완벽하게 동일한 조건(대기조건, 엔진/촉매 상태 조건 등)에서 수행되지 않았기 때문에 발생하는 것으로 보인다.
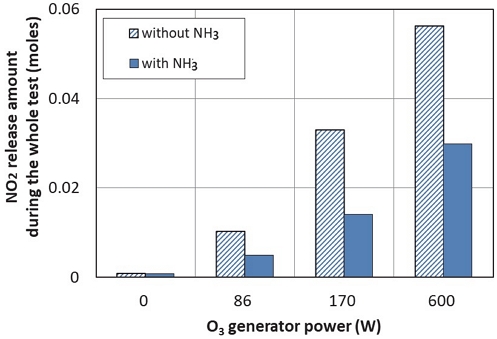
Fig. 9는 실험 전 과정에서 배출된 NO2의 총 몰수를 비교하여 나타낸다. 오존 생성기에 공급되는 전력이 클수록 많은 양의 NO2가 배출되는 것을 알 수 있다. 이는 오존을 많이 공급할수록 NO가 많이 NO2나 HNO3 전환되어 촉매에 흡착되어 있다가 탈착되기 때문이다. 그리고, NO2 배출량은 NH3 공급할 때가 NH3를 공급하지 않았을 때보다 약 50 % 수준으로 감소하는 것을 알 수 있다. 이는 엔진의 운전조건이 바뀌어 전부하조건에서 NO가 유입되면서 NH4NO3 일부가 N2와 H2O로 전환되는 영향을 받는 것으로 보인다.
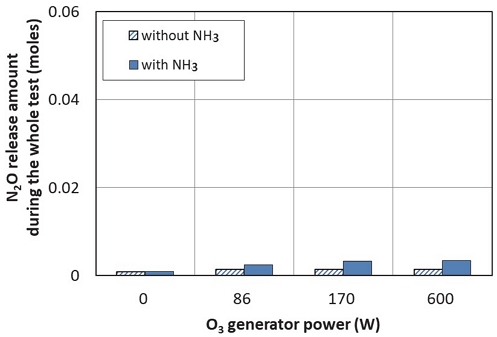
Fig. 10은 실험 전 과정에서 배출된 N2O의 총 몰수를 비교하여 나타낸다. NH3를 공급하지 않았을 때 배출되는 N2O 양은 오존 생성기에 공급되는 전력량과 무관하게 거의 일정함을 알 수 있다. NH3를 공급하지 않았을 때 배출되는 N2O는 Fig. 7의 설명에서 언급한 바와 같이 엔진 연소나 DOC에서 발생하는 것으로 보인다. 그리고, NH3를 공급할 때가 NH3를 공급하지 않았을 때보다 N2O 배출량은 증가하는 것을 알 수 있다. 이는 오존에 의한 NO2나 HNO3가 NH3와 반응하여 NH4NO3를 생성하고, 그 일부가 열분해되어 N2O로 전환되기 때문으로 보인다. 참고로 오존 발생기에 600 W의 전력을 공급하고, NH3를 공급했을 때 발생한 N2O의 양은 0.0031 mol로써 이 조건에서 NO2 배출량의 10.4 %이었다.
Fig. 11은 실험 전 과정에서 저감된 NO의 총 몰수를 비교하여 나타낸다. 실험 전 과정에서 저감된 NO의 몰수는 O3를 공급하는 동안 감소된 NO의 몰수에서 실험 전 과정 동안 발생한 NO2와 N2O의 몰수를 제하여 얻어졌다. O3를 공급하지 않았을 때 NO는 거의 저감되지 않는다. O3 공급량이 170 W가 될 때까지는 오존 생성기에 공급된 전기량이 증가할수록 NO 저감량이 증가하다가 오존 생성기에 더 많은 전기량(600 W)이 공급되면 NO 저감량이 감소되는 경향을 보인다. 이는 Fig. 6(a)에서 설명한 바와 같이 O3 공급량이 O3/NOinlet 몰비가 1.0 이상인 경우 NO2가 더 산화된 HNO3 형태로 SCR 촉매 전단에 유입되는데 약한 세기로 많은 양의 NO3가 흡착되어 있다가 Idle 조건에서 오존 분사가 중지되어 평형상태가 깨어지면 이들이 NO2로 배출되기 때문으로 해석된다. 따라서 O3 공급 시에 NH3가 함께 공급되며, O3/NOinlet 몰비율 “1”인 시점인 오존 생성기 170 W에서 가장 좋은 저온 영역 NO 저감률을 갖는다.
4. 결 론
디젤 엔진의 저온 조건 NOx 저감을 위해 오존을 Cu-zeolite 촉매 전단에 공급하였고, 이때 NOx의 거동을 관찰하였으며, 다음과 같은 결론을 얻을 수 있었다.
- 1) SCR 전단에 공급된 오존은 NO와 선택적으로 반응하여 NO2로 산화시킨다. 오존공급량을 더 증가시키면 NO2가 산화되어 NO3, HNO3 등으로 전환된다.
- 2) NO는 Cu-zeolite 촉매에 흡착되지 않지만, 오존에 의해 전환된 NO2와 HNO3는 Cu-zeolite 촉매에 흡착된다. NO2가 촉매에 흡착되는 과정에서 NO가 발생하고, 탈착 과정에서 NO를 소모하는 것으로 보아 NO3 형태로 흡착되는 것으로 보인다. 오존을 많이 공급하여 생성된 질소산화물(HNO3)은 흡착과정에서 NO를 발생하지 않으며, 오존공급이 중지되었을 때 낮은 온도에서도 NO2로 탈착되는 특성을 보였다. SCR NOx 저감 반응에 흡착과정에서 NO가 발생하지 않는 것은 긍정적으로 기여하며, 낮은 온도에서 NO2가 탈착되는 것은 부정적으로 기여할 것으로 판단된다.
- 3) 오존과 NH3를 동시에 공급하면 NH4NO3가 형성된다. NH4NO3는 NO가 유입되고 온도가 상승하는 조건에서 N2와 H2O로 전환되고, 이 과정에서 NH4NO3 생성반응에 참여한 NO의 약 50 %가 N2로 전환된다.
- 4) 오존과 NH3를 동시에 공급할 때 오존공급량이 증가하면 N2O 배출량이 증가하였고, 그 배출량은 NO2 배출량의 10 % 수준이었다.
- 5) 저온에서 오존과 NH3를 공급하면 NO를 촉매에 NO3 형태나 NH4NO3로 흡착시킬 수 있으며, 추후 엔진 운전조건이 고온 조건으로 변화되는 과정에서 흡착되어 있던 NO3나 NH4NO3를 N2로 전환하여 NOx 저감률을 일부 향상 시킬 수 있을 것으로 보인다.
Acknowledgments
이 연구는 환경부/한국환경산업기술원의 지원으로(과제명: 비대칭 S-DPF 이용 운행 대형차 복합재생 PM-NOx 동시저감 장치 성능 최적화 개발 및 DPF 파손 진단 기술 개발, 과제번호: 2021003390004) 수행되었으며, 이에 감사드립니다.
References
-
S. Sato, and M. Hosoya, “Improvement of Low-Temperature Performance of the NOx Reduction Efficiency on the Urea-SCR Catalysts,” SAE 2013-01-1076, 2013.
[https://doi.org/10.4271/2013-01-1076]

-
J. Girard, G. Cavataio, R. Snow, and C. Lambert, “Combined Fe-Cu SCR Systems with Optimized Ammonia to NOx Ratio for Diesel NOx Control,” SAE International Journal of Fuels and Lubricants, Vol.1, No.1, pp.603-610. 2009.
[https://doi.org/10.4271/2008-01-1185]

-
R. Zhang, N. Liu, Z. Lei, and B. Chen, “Selective Transformation of Various Nitrogen-Containing Exhaust Gases Toward N2 Over Zeolite Catalysts,” Chemical Reviews, Vol.116, pp.3658-3721, 2016.
[https://doi.org/10.1021/acs.chemrev.5b00474]

-
A. M. Beale, F. Gao, I. Lezcano-Gonzalez, C. H. F. Peden and J. Szanyi, “Recent Advances in Automotive Catalysis for Nox Emission Control By Small-Pore Microporous Materials,” Chemical Society Reviews, Vol.44, pp.7371-7405, 2015.
[https://doi.org/10.1039/C5CS00108K]

-
F. Liu, Y. Yu, and H. He, “Environmentally-Benign Catalysts for the Selective Catalytic Reduction of Nox From Diesel Engines: Structure–Activity Relationship and Reaction Mechanism Aspects,” Chemical Communications, Vol.50, pp.8445-8463, 2014.
[https://doi.org/10.1039/C4CC01098A]

-
H. S. Kim, and Y. I. Jung, “The Trend and Prospect on the Policies and Technologies for Reducing Emissions and Green House Gases from Vehicles Using Internal Combustion Engines since 2000,” Journal of Korean Society for Atmospheric Environment, Vol.39, No.5, pp.696-709, 2023.
[https://doi.org/10.5572/KOSAE.2023.39.5.696]

-
H. Lee, C. Yoon, and H. Kim, “A Study on Reaction Rate of Solid SCR for NOx Reduction of Exhaust Emissions in Diesel Engine,” Transactions of KSAE, Vol.21, No.6, pp.183-194, 2013.
[https://doi.org/10.7467/KSAE.2013.21.6.183]

-
W. Kang, H. Jang, S. Woo, S. Lee, S. Yi, and H. Kim, “A study on the Possibility of Using a Burner for SDPF System to Reduce Emissions of In-use Non-road Vehicles,” Transactions of KSAE, Vol.30, No.8, pp.649-659, 2013.
[https://doi.org/10.7467/KSAE.2022.30.8.649]

-
H. Y. Chen, S. Mulla, E. Weigert, K. Camm, T. Ballinger, J. Cox, and P. Blakeman, “Cold Start Concept (CSC™): A Novel Catalyst for Cold Start Emission Control,” SAE International Journal of Fuels and Lubricants, Vol.6, pp.372-381, 2013 .
[https://doi.org/10.4271/2013-01-0535]

-
F. Gao, and C. H. F. Peden, “Recent Progress in Atomic-Level Understanding of Cu/SSZ-13 Selective Catalytic Reduction Catalysts – Review,” Catalysts, Vol.8, No.4, p.140, 2018.
[https://doi.org/10.3390/catal8040140]

- Y. Tsukamoto, S. Utaki, T. Fukuma, and J. Kusaka, “Reactivity Analysis and Modeling of Cu-SCR Based on NH3-SCR Mechanism Considering Cu Redox,” Transactions of Society of Automotive Engineers of Japan, Vol.49, pp.1211-1216, 2018.
-
Y. Qian, S. Yasumura, S. Mine, T. Toyao and K. Shimizu, “Low-Temperature NOx Capture and Reduction Via NO Oxidation by O3 on Cu-CHA,” Applied Catalysis A, General, Vol.655, 2023.
[https://doi.org/10.1016/j.apcata.2023.119099]

-
F. Lin, Z. Wang, Z. Zhang, Y. He, Y. Zhu, J. Shao, D. Yuan, G. Chen, and K. Cen, “Flue Gas Treatment With Ozone Oxidation: An Overview on Nox, Organic Pollutants, and Mercury,” Chemical Engineering Journal, Vol.382, Paper No.123030, 2020.
[https://doi.org/10.1016/j.cej.2019.123030]

-
Y. S. Mok, and H. J. Lee, “Removal of Sulfur Dioxide and Nitrogen Oxides By Using Ozone Injection and Absorption-Reduction Technique,” Fuel Processing Technology, Vol.87, pp.591-597, 2006.
[https://doi.org/10.1016/j.fuproc.2005.10.007]

-
R. Ji, J. Wang, W. Xu, X. Liu, T. Zhu, C. Yan, and J. Song, “Study on the Key Factors of No Oxidation Using O3: the Oxidation Product Composition and Oxidation Selectivity,” Industrial & Engineering Chemistry Research, Vol.57, pp.14440-14447, 2018.
[https://doi.org/10.1021/acs.iecr.8b03597]

-
K. Skalska, J. S. Miller, and S. Ledakowicz, “Kinetic Model of NOx Ozonation and Its Experimental Verification,” Chemical Engineering Science, Vol.66, pp.3386-3391, 2011 .
[https://doi.org/10.1016/j.ces.2011.01.028]

-
I. Jõgi, K. Erme, J. Raud, and M. Laan, “Oxidation of NO by Ozone in the Presence of TiO2 Catalyst,” Fuel, Vol.173, pp.45-51, 2016.
[https://doi.org/10.1016/j.fuel.2016.01.039]

-
S. Bhowmick, A. Badiwal, and K. T. Shenoy, “Removal of NOx Using Ozone Injection and Subsequent Absorption in Water,” Chemical Engineering Journal Advances, Vol.15, Paper No.100511, 2023.
[https://doi.org/10.1016/j.ceja.2023.100511]

- M. Liu, J. Li, Z. Liu, Y. Zhao, N. Jiang, and Y. Wu, “Improve Low-Temperature Selective Catalytic Reduction of NOx with NH3 by O3 Injection,” International Journal of Plasma Environmental Science & Technology, Vol.14, 2020.
-
M. Nagata, Y. Hanaki, A. Ikeda, and Y. Sekine “Effect of Ozone Addition to Lean NOx Trap Method Using Plasma-Catalyst System,” Plasma Chemistry and Plasma Processing, Vol.34, pp.1303-1315, 2014.
[https://doi.org/10.1007/s11090-014-9568-7]

-
K. Seki, and J. Kusaka, “Reaction Analysis and Modeling of Fast SCR in a Cu-Chabazite SCR Catalyst Considering Generation and Decomposition of Ammonium Nitrate,” SAE 2021-24-0073, 2021.
[https://doi.org/10.4271/2021-24-0073]