알루미노- 및 니켈 실리케이트 분자체 흡착제에 대한 BTX 흡착 거동 연구
Copyright Ⓒ 2022 KSAE / 196-05
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium provided the original work is properly cited.
Abstract
Amid continuously increasing environmental problems, the solution to these problems is being studied thoroughly. Eventually, volatile organic compounds(VOCs) can cause serious diseases, such as cancer, loss of sight, unconsciousness, etc. Therefore, many studies have been explored recently. Among the studies, the adsorption study has drawn plenty of attention due to the easy and economical process and high removal performance. However, there is still a desire to develop a high-performance adsorbent. In this study, VOC adsorbents were prepared through hydrothermal synthesis(Al-MWW) and some post-treatments(Al-delMWW, Ni-MWW, Ni-delMWW, and Ni-BEA), while their VOC adsorption performances, which were separated into total and chemisorbed amounts, were evaluated, depending on the type of adsorbates(BTX). Synthesized adsorbents were characterized via powder XRD, N2 sorption, IR spectroscopy, STEM-EDS, and ICP elemental analysis.
Keywords:
VOCs, BTX, Adsorption, Zeolite, Molecular sieve, Nickel silicate키워드:
휘발성 유기화합물, 벤젠, 톨루엔, 자일렌, 흡착, 제올라이트, 분자체, 니켈 실리케이트1. 서 론
휘발성 유기화합물(Volatile Organic Compounds, VOCs)은 호흡기 질환, 두통, 눈 자극성을 일으킬 수 있어 인체에 매우 유해하고, 대기 중에서 질소산화물과 함께 광화학 반응을 일으켜 광화학 산화성 물질인 오존 등을 생성시켜 광화학스모그를 발생시키기도 한다. 또한 VOCs는 최근 가장 큰 주목을 받고 있는 미세먼지 생성의 1차 전구체로 알려져 있어 매우 유독한 대기오염 물질 중 하나이다.1,2) 이 같은 VOCs는 다양한 발생원을 통해 생성될 수 있는데, 통계에 따르면 2017년 한 해 동안 배출된 총 VOCs 약 100만톤 중 일반적으로 도로 위를 다니는 승용차, 버스, 이륜차, 등으로 대표되는 도로이동오염원의 배출량은 약 46,000톤으로 전체의 약 5 %를 차지한다. 특히, 도로이동오염원으로부터 VOCs의 주 발생원은 방향족 탄화수소 화합물 즉, 대표적으로 벤젠(Benzene), 톨루엔(Toluene), 자일렌(Xylene) (BTX)으로 알려져 있으며, 이들 화합물의 저감은 환경적으로 중요한 이슈라고 할 수 있다.3)
BTX 저감을 위한 다양한 시도 중 흡착에 의한 제거는 상대적으로 쉽고 에너지 효율적인 공정으로 인한 경제적 이점이 높아 가장 많은 관심을 받고 있으며, 다양한 관련 연구 결과들이 발표되고 있다.4) US EPA는 여러 흡착 물질 후보군 중 활성탄(Activated Carbon, AC), 유기 폴리머(Organic Polymer, OP), 제올라이트(Zeolite)를 가장 유망한 세 개의 흡착제로 평가하고 있다.5) 이 중 AC는 높은 비표면적(600~1,400 m2/g)과 세공 부피(0.5~1.4 cm3/g)로 인해 높은 VOCs 흡착량을 나타내지만, 가연성에 의한 화재 위험성을 가지고 있고 재생이 어렵다는 단점이 있다.6) OP는 높은 비표면적 뿐만 아니라 높은 소수성으로 인해 VOCs에 대한 차세대 흡착제로 평가되고 있다. 하지만, 복잡한 합성 과정으로 인해 상용화에 한계가 있다는 평가를 받는다.7) 이에 반해 제올라이트는 높은 비표면적과 열적 안정성을 가지고 있고, 골격 구성원소의 조성을 조절하여 표면 흡착 특성을 조절할 수 있어 유망한 흡착제로써 활발히 연구되고 있다.8)
제올라이트를 흡착제로서 이용한 VOCs 흡착 연구에 있서 중요한 변수는 세공의 직경과 비표면적으로 알려져 있으며, 이 값이 클수록 흡착 성능이 뛰어나다.9,10) MFI 제올라이트의 독특한 구조적 특성 즉, 직진 및 지그재그 형태의 채널에 따른 톨루엔 흡착 특성의 변화가 보고되었다.10) 이 같은 제올라이트의 물리적 특성 뿐 아니라 화학적 특성도 VOCs 흡착에 지대한 영향을 끼치는 것이 보고되기도 하였다.11) 여러 금속 또는 무기 양이온의 종류에 따라 생성 되는 루이스 산점을 통해 더 높은 흡착특성이 나타나는 것으로 알려져 있다.12,13) 또한, 비극성인 BTX 화합물은 물의 극성을 1.0으로 할 때 각각의 극성지수가 0.111, 0.099, 0.074를 나타내며,14) 따라서 소수성이 강한 흡착제에 더 높은 흡착 효율이 나타나는 것으로 보고되어 있다.9,15) 하지만, 물리적 특성과 화학적 특성은 상충관계에 있을 수 있으며, 따라서 적절한 처리를 통한 최적의 제올라이트 흡착제 개발은 여전히 진행 중에 있다.
본 연구에서는 한 단계 반응을 통한 3차원과 2차원 구조 특성을 조절 할 수 있는 MWW 계열 제올라이트의 합성과 3차원 MWW로부터 내부구조전환에 의해 *BEA 계열 분자체 흡착제를 준비하였다. 또한, 제올라이트 골격 원소의 종류에 따른 알루미노실리케이트와 니켈 실리케이트 MWW 및 *BEA 분자체 흡착제의 BTX 흡착 특성 거동에 대한 연구를 수행하였다.16)
2. 실험방법
2.1 흡착제 합성
알루미노실리케이트 MWW 전구체 Al-MWW(P)와 보로실리케이트 B-MWW(P)는 아래와 같은 과정으로 합성하였다.17) 먼저, 헥사메틸렌이민(HMI, 99 %, Sigma-Aldrich)와 수산화 나트륨 용액(NaOH, 50 %, Sigma-Aldrich)을 탈이온수에 용해시켜 주었다. Al-MWW(P)의 경우는 연속적으로 알루민산 나트륨(Kanto)을 넣고 첨가한 시약들이 완전히 용해 될 때까지 교반해 준 후, 흄드 실리카(100 %, Evonik)를 첨가해주어 24시간 동안 교반하여 제조하였다. Al-MWW(P) 합성 모액조성은 15.0 HMI : 1.7 Na2O : 1.0 Al2O3 : 30.0 SiO2 : 1350 H2O 이다. 합성 모액은 160 °C에서 7일동안 100 rpm을 가해주어 수열 합성하였다. B-MWW(P)는 알루민산 나트륨 대신 붕산(99.5 %, Junsei)을 첨가해 위와 같은 과정으로 모액을 준비했다.18) B-MWW(P) 합성 모액 조성은 20.0 HMI : 20.0 B2O3 : 30.0 SiO2 : 570 H2O 이며, 175 °C에서 7일동안 100 rpm을 가해주어 합성하였다. 수열 합성된 시료는 여과를 한 후 실온에서 건조하였다. 그 후 550 °C에서 8시간 동안 소성시켰다. 소성한 시료를 1.0 M 질산 암모늄 용액을 제올라이트 1 g 당 100 mL를 사용하여 80 °C에서 6시간 동안 암모늄 이온으로 이온교한 한 후, 500 °C에서 2시간동안 소성하여 최종적으로 Al-MWW와 B-MWW를 준비하였다.
Al-delMWW와 B-delMWW는 아래와 같은 층간박리법으로 준비하였다.19) 각각 Al-MWW(P)와 B-MWW(P)를 세틸트리메틸암모늄 브롬화물(CTAB, 99 %, Sigma-Aldrich)와 탈 이온수에 첨가해 혼합한 후, 연속적으로 수산화 테트라프로필암모늄 용액(40 %, Sachem)을 혼합 용액에 첨가하였다. 이 후, 80 °C에서 16시간동안 용액을 환류시켜 MWW 층간 팽창을 진행하였다. 그 후 50 °C 보다 낮은 온도에서 음파파쇄를 통해 MWW 층들의 층간박리를 수행하였다. 마지막으로 pH가 2 이하가 되도록 1.0 M 염산용액을 떨어뜨려 주었고, 원심분리법으로 고체 물질을 회수하였다. 이렇게 얻은 고체 물질을 상온에서 건조 후에, 시료 내에 유기 물질을 공기분위기의 550 °C에서 8시간동안 소성하여 제거하였다.
B-MWW(P)의 내부구조전환에 의해 3차원 및 2차원 MWW 구조를 갖는 니켈 실리케이트 Ni-MWW와 Ni-delMWW를 합성하였다. B-MWW(P)를 1.0 M 질산니켈 수용액에 첨가하여 균일하게 되도록 혼합한 후, 각각 100(Ni-MWW), 160 °C(Ni-delMWW)에서 4일동안 수열 합성하였다. 수열 합성한 시료는 여과하여 상온에서 건조시킨 후, 550 °C에서 8시간동안 소성하였다.20)
Al-BEA는 상용 NH4+ 베타 제올라이트(Zeolyst CP-814e, Si/Al = 12.5)를 550 °C 공기분위기 조건에서 2시간 소성을 통해 준비하였다. B-BEA와 Ni-BEA는 각각 B-MWW와 Ni-MWW의 내부구조전환에 의해 준비하였다. B- 또는 Ni-MWW와 이 물질의 10 wt.%에 해당하는 탈알루미늄 베타 제올라이트를 수산화 테트라에틸암모늄 수용액(TEAOH, 35 %, Sigma-Aldrich)에 첨가해 균일하게 혼합시켰다. 그리고 플루오린화 암모늄을 첨가 후 교반시켜 균일 혼합 모액을 준비하였다.21) 이 합성 모액의 조성은 1.0 SiO2 : 0.5 HF : 0.3 TEAOH이며, 80 °C에서 약 1시간 동안 건조시킨 후 190 °C에서 12 시간 동안 수열 처리하였다. 합성한 고체 생성물은 550 °C에서 8시간 소성하여 구조 내에 존재하는 유기물을 제거하였다.
2.2 특성분석
합성한 흡착제의 Powder X-Ray Diffraction(PXRD) 패턴은 Rigaku SmartLab 분석기를 사용해 40 kV, 30 mA에서 가속시킨 Cu-Kα 복사선으로 측정하였다. N2 흡탈착 분석에 의한 BET 비표면적 계산은 Micromeritics Tristar II 분석기를 사용하여 측정하였다. 원소분석은 PerkinElmer OPTIMA 7,300 DV Inductively Coupled Plasma(ICP) 분광기를 이용하여 측정하였다. 제올라이트 구조 영역 IR 스펙트럼은 Shimadzu IRTracer-100 FT-IR 분석기를 사용하여 ATR 모드에서 측정하였다. STEM-EDS 및 High-Angle Annular Dark-Field(HAADF) 이미지는 200 kV 가속전압을 이용한 FEI TALOS F200X를 통해 측정하였다.
2.3 흡착 성능 평가
합성한 흡착제의 벤젠, 톨루엔, 자일렌 흡-탈착실험은 직접 제작한 연속 고정층 흡착장치에서 수행하였다. 흡착제 0.2 g을 고정층에 두고 99.999 % N2 30 cc/min 흐름과 500 °C(승온속도 = 10 °C/min) 조건에서 2시간 동안 전처리하였다. 전처리 후 같은 기체 흐름에서 60 °C로 온도를 낮추었다. 그 후 약 40분 동안 200 ppm 벤젠 20 cc/min, 100 ppm 톨루엔 40 cc/min, 또는 100 ppm 자일렌 40 cc/min을 주입시켜 흡착 파과 곡선(Breakthrough curve)을 얻었다.
흡착실험 후 연속적으로 각 흡착제에 따른 BTX의 탈착 거동을 확인하였다. 먼저, 약 30분 동안 충분히 99.999 % N2 30 cc/min을 흘려주어 물리 탈착 시켰다. 그리고 60 °C에서 500 °C로 승온시키며 (승온속도 = 10 oC/min) 온도프로그램탈착(Temperature Programmed Desorption, TPD) 데이터를 얻었다. 물리탈착, 흡착 파과 곡선 및 TPD 곡선은 VF-5ms 모세관 컬럼(60 m x 0.32 mm)이 장착된 Scion 456 기체 크로마토그래피와 FID 검출기를 통해 측정하였다.
벤젠, 톨루엔, 자일렌의 총 흡착량 및 화학 흡착량은 각각 흡착 파과 곡선 및 TPD 곡선을 통해 구하였다. 총 흡착량 QVOC(benzene, toluene, or xylene)은 아래와 같은 계산식을 통해 구하였다.9)
이 식에서 F는 부피 유량(m3/min), CVOCin은 각 VOC의 주입 농도(mol/m3), C는 흡착 시간에 따른 각 VOC의 흡착양(mol/m3), m은 흡착제의 양(g), ts는 제올라이트가 흡착 포화될 때까지의 시간이다. 화학 흡착량은 각 휘발성 유기화합물의 GC-FID 크로마토그램 면적과 주입량의 검량 곡선으로부터 계산한 감응인자를 이용하여 계산하였으며, 물리 흡착량은 (총 흡착량(QVOC) – 화학 흡착량)으로 계산하였다.
3. 결과 및 토론
3.1 흡착제 특성분석
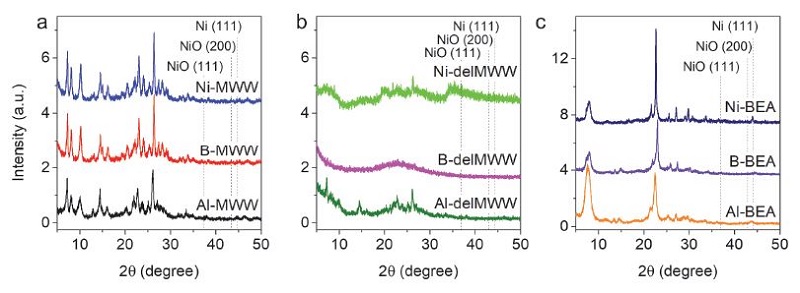
준비한 아홉 종의 소성 후 분자체 시료에 대한 PXRD 분석 결과를 Fig. 1에 나타내었다. MWW 시료는 2θ = 7.4°, 8.1°, 9.9°에서 각각 MWW (100), (101), (102) X-ray 피크가 관찰되었다.22) delMWW는 층간박리로 인한 MWW 층의 무질서도로 인해 3차원 MWW 구조의 특성 XRD 패턴이 거의 관찰되지 않았다. BEA 시료의 경우 2θ = 7.7°, 22.4°의 X-ray 피크가 관찰되었고, 다른 특성 피크는 관찰되지 않아 *BEA 구조가 잘 형성되었음을 알 수 있다.23) 또한, 합성한 모든 시료가 550 °C에서의 소성 후에도 여전히 결정성이 그대로 유지되었음을 알 수 있다. 한편, 세 구조의 니켈 실리케이트 시료의 PXRD 패턴에서 금속 니켈과 산화 니켈에 해당하는 X-ray 피크가 관찰되지 않아서 소성 후에도 여전히 골격 구조 내에 니켈이 높은 분산도로 존재함을 알 수 있다.
PXRD patterns of calcined alumino-, boro-, and nickel-silicate (a) MWW (b) delMWW, and (c) *BEA molecular sieves
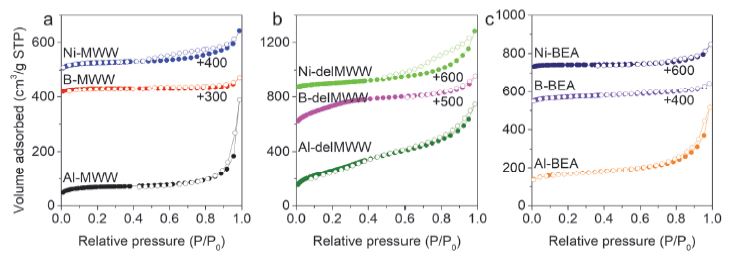
소성 후 분자체 시료에 대한 N2 흡-탈착 등온선 및 이로부터 계산된 BET 비표면적을 Fig. 2와 Table 1에 각각 나타내었다. MWW와 *BEA 구조의 분자체 시료들은 마이크로세공구조의 Type I 등온선을 보였고, delMWW 시료들은 메조세공구조의 Type IV 등온선을 보였다. 한편, Al-MWW에 비해 Ni-MWW는 부분적으로 일어난 층간박리로 인해 생성된 2차원 MWW 구조로 외표면적은 증가하고 마이크로세공면적은 감소하였다. Ni-delMWW는 전체 표면적이 Al-delMWW의 802 m2/g에 비해 376 m2/g으로 크게 감소하였는데, 이는 상대적으로 Ni의 분자량(58.69 g/mol)이 Al(26.98 g/mol)에 비해 커서 단위 질량당 표면적이 작게 측정되었고, 또한 합성 과정 중 사용한 Ni(NO3)2 수용액의 산성(pH~3.8)으로 일부 불안정한 구조 특성으로 해석할 수 있다. 반면, Ni-BEA는 Al-BEA에 비해 외표면적이 감소하고 오히려 마이크로세공면적이 증가하는 상반된 결과를 보여주었다.
N2 sorption isotherms of alumino-, boro-, and nickel silicate (a) MWW, (b) delMWW, and (c) *BEA molecular sieves
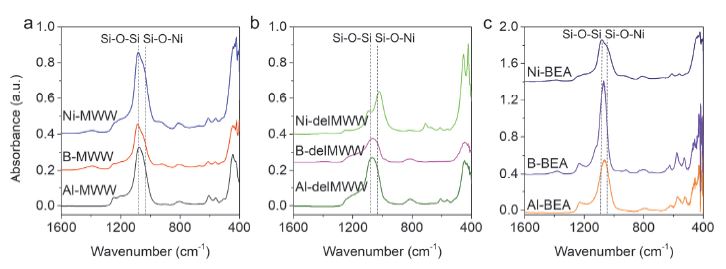
Fig. 3은 MWW, delMWW, *BEA 구조 분자체 시료대한 구조 영역 IR 스펙트럼을 보여준다. 모든 MWW와 delMWW 구조 시료는 445, 569, 611, 809, 1,080, 1,183, 1,243, 1,398 cm-1에서 MWW 고유의 IR 흡착 특성 피크들이 존재하였다.24) 또한, *BEA 구조의 시료들에서는 525, 573 cm-1에서 각각 육각, 오각 고리의 흡착 피크가 확인되었다.23) 한편, 4배위 골격 구조 내에 니켈 원소가 치환되면서 모든 구조의 니켈 실리케이트 분자체 시료의 IR 흡착 스펙트럼의 1,020 cm-1에서 Si-O-Ni에 해당하는 특성 피크가 추가적으로 생성되는 것을 확인할 수 있다.25)
IR spectra in the structural region of alumino-, boro-, and nickel silicate (a) MWW, (b) delMWW, and (c) *BEA molecular sieves
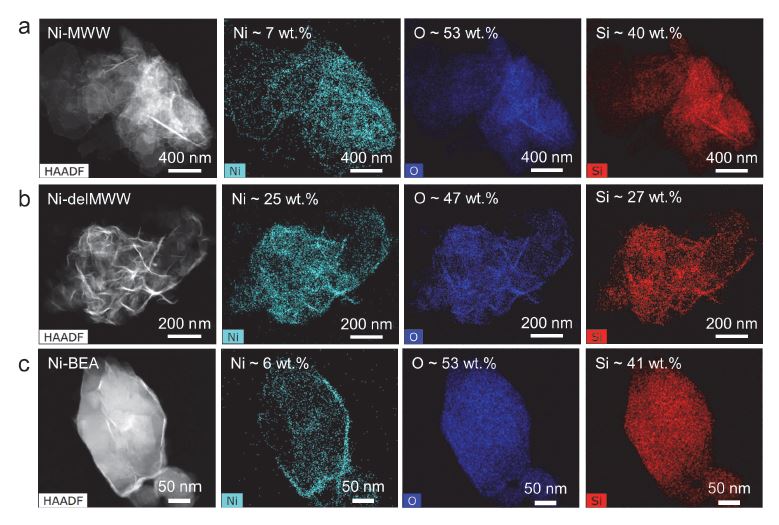
Fig. 4는 니켈 실리케이트 MWW, delMWW, BEA 분자체 시료의 STEM-EDS 이미지들을 보여준다. 모든 니켈 실리케이트에서 니켈의 함량에 상관없이 니켈이 구조 내에 매우 고르게 분포하고 있음을 확인 할 수 있다. 또한, 각 구조의 보로실리케이트 시료와 비교하여 니켈 실리케이트 시료들의 Si/B가 증가한 결과를 확인할 수 있다(Table 1). 따라서, 세 구조의 니켈 실리케이트 합성 과정 중 4배위 골격 구조 내 붕소가 제거되고 니켈이 치환되었으며, 모든 구조에서 니켈 원소가 매우 고르게 분산되어 있음을 확인할 수 있다.
3.2 BTX 흡착 거동 분석
Fig. 5는 알루미노실리케이트와 니켈 실리케이트 MWW, delMWW, BEA 흡착제에 따른 벤젠, 톨루엔, 자일렌의 흡착 파과 곡선과 TPD 곡선을 보여준다. 또한, 이로부터 계산된 각 흡착질의 총 흡착양, 화학 흡착양, 물리 흡착양을 Fig. 6(a)~(c)와 Table 2에 나타내었다. 먼저, 알루미노실리케이트 흡착제 간을 비교해봤을 때, 벤젠의 총 흡착양은 Al-BEA과 Al-MWW가 Al-delMWW보다 더 많은 반면, 톨루엔과 자일렌의 총 흡착양은 Al-delMWW이 더 많았다. Al-delMWW은 모든 흡착질에 대한 화학 흡착량이 가장 낮았는데, 이는 BTX보다 작은 Al-delMWW의 세공크기(10-ring, 4.1 × 5.1 Å)와 열린구조의 Hemi-cage만을 갖는 2차원 구조 특성, 그리고 수산기(-OH)로 인한 친수성으로 대부분의 소수성 흡착질이 외표면에 물리 흡착되었기 때문으로 보여진다.
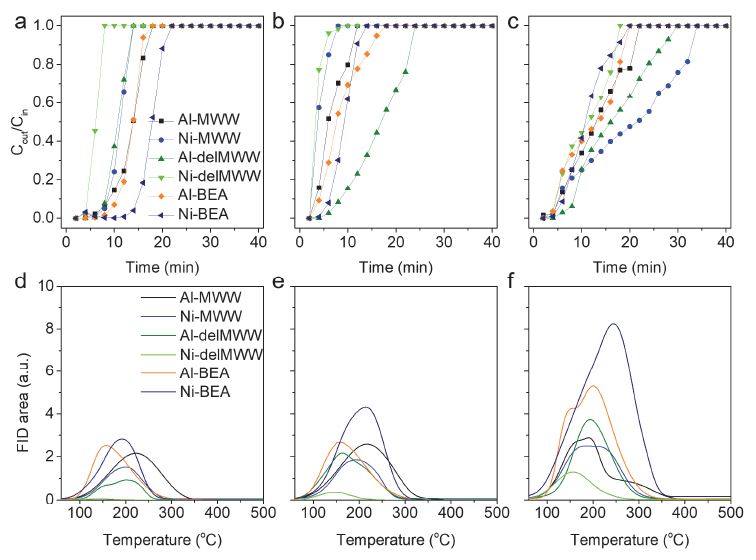
BTX adsorption breakthrough curves(top) and TPD profiles(bottom) of (a, d) benzene, (b, e) toluene, and (c, f) xylene over six different alumino- and nickel silicate adsorbents studied here
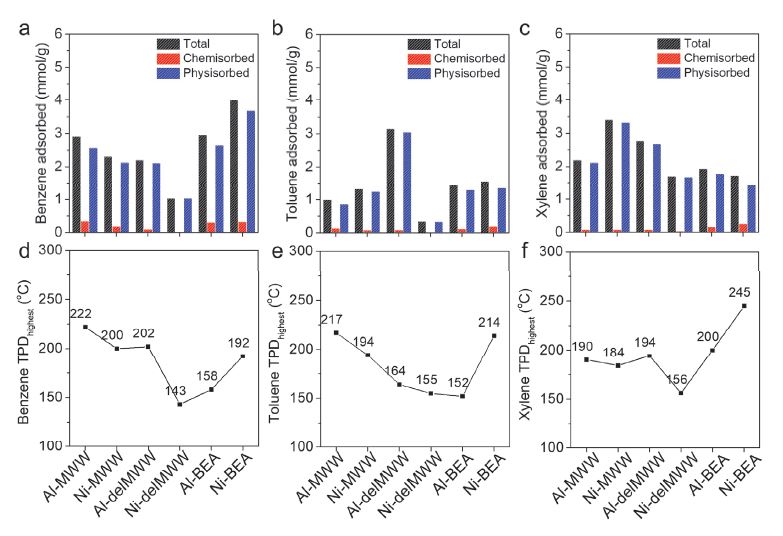
Adsorbed amounts(top) and TPDhighest temperatures(bottom) of (a, d) benzene, (b, e) toluene, and (c, f) xylene of six different alumino- and nickel silicate adsorbents studied here
Fig. 6과 Table 2에서 보는바와 같이, 화학흡착은 3차원 구조의 알루미노실리케이트에서 많이 발생했는데, 벤젠과 톨루엔의 화학 흡착량과 흡착 세기 모두 Al-MWW이 Al-BEA보다 강했다. 반면, 가장 크기가 큰 자일렌은 Al-BEA에서 더 많은 화학 흡착양을 보였고, 또한 강하게 흡착하고 있음을 알 수 있다. 이는 벤젠과 톨루엔은 Al-MWW의 4.0 × 5.5 Å 크기의 10-ring 세공 입구를 통과해 7.1 × 18.2 Å 크기의 Supercage와의 상호작용이 상대적으로 세공의 크기가 큰 Al-BEA(12-ring (6.6 × 6.7 Å) ↔ (5.6 × 5.6 Å))보다 강하지만, 자일렌에 대해서는 MWW의 세공 입구보다 자일렌 분자의 크기가 크기 때문으로 볼 수 있다. 따라서 이와 같은 결과를 통해 휘발성 유기화합물의 흡착은 흡착제의 세공 구조와 형태 모두에 영향을 받는 다는 것을 알 수 있다.
각 MWW, delMMW, *BEA 구조들의 알루미노실리케이트와 니켈 실리케이트 흡착제에 대한 벤젠, 톨루엔, 자일렌의 흡착 특성을 비교해보면, Ni-BEA만 Al-BEA보다 화학 흡착량과 탈착 온도가 증가하였음을 볼 수 있다. 또한, Ni-BEA가 다른 니켈 실리케이트 흡착제들 보다 벤젠, 톨루엔, 자일렌 모두의 화학 흡착량이 상대적으로 많은 것을 볼 수 있다. 이는 4배위 골격 구조 내 니켈의 루이스 산 특성으로 인해 모든 BTX 분자와의 더 강한 화학 흡착을 이룬 것으로 해석할 수 있다. 반면, 3차원 Ni-MWW 흡착제는 알루미늄 원자에 비해 크기가 큰 니켈 원자로의 치환이 세공 입구를 좁혀 세공을 통과하여 구조 내로 흡착되는 양이 감소하게 되고, 세공 밖 즉, 외표면에서의 흡착이 우세하여 상대적으로 적은 화학 흡착양과 약한 흡착 세기를 보이는 것으로 생각할 수 있다. 한편, 2차원 구조이며 외표면에 많은 수산기에 의해 높은 친수성을 나타내는 Ni-delMWW는 표면적도 크게 줄어 BTX 분자를 거의 흡착하지 못하는 결과를 확인할 수 있다. 따라서, 루이스 산점인 니켈이 치환되더라도 제올라이트 고유의 구조 및 물리화학적 특성에 따라 흡착 특성이 변화하는 것을 알 수 있다.
4. 결 론
본 연구에서는 3차원 MWW 구조와 이 물질로부터 파생된 2차원 MWW 구조, 그리고 *BEA 구조의 알루미노실리케이트와 니켈 실리케이트 흡착제를 합성하여 흡착제에 따른 휘발성 유기화합물의 흡착 성능을 평가하였다. PXRD와 BET 분석에서 각 구조의 특성 PXRD 패턴을 나타내고, 특정 타입의 N2 흡착 등온선을 보이는 것으로부터 소성 후에도 제올라이트 분자체 구조체가 유지됨을 확인하였다. 하지만 각 구조마다 서로 다른 경향의 외표면적과 마이크로세공표면적의 증가/감소를 보였다. 구조영역 IR, STEM-EDS, ICP 원소분석을 통해 니켈-실리케이트 흡착제들은 시작 물질인 보로실리케이트에 비해 골격 구조 내에 붕소가 제거되는 동시에 니켈이 치환되어 구조 내에 높게 분산된 니켈 원소들이 존재함을 보여주었다. 60 °C의 동일한 흡착온도에서 알루미노실리케이트 흡착제 간 BTX 흡착 특성은 크기가 가장 작은 벤젠은 3차원 MWW, *BEA구조에서 총 흡착량이 더 많았으나, 상대적으로 크기가 큰 톨루엔과 자일렌은 2차원 구조의 Al-delMWW가 더 많은 총 흡착량을 보여주었다. 하지만, 화학흡착에서는 3차원 구조가 BTX와의 상호작용에 더 유리하여 더 많은 화학 흡착량을 보여주었고, 그 크기에 따라 벤젠과 톨루엔은 Al-MWW에서 그리고 상대적으로 크기가 큰 자일렌은 Al-BEA가 더 많은 화학 흡착양을 나타내었다. 니켈 실리케이트 흡착제 중에서는 골격 구조 내 니켈의 루이 산 특성 뿐만 아니라 마이크로세공면적과 세공 입구 크기가 가장 큰 Ni-BEA에서 BTX의 화학 흡착양이 가장 많았다. 반면, 세공의 크기가 줄어든 Ni-MWW와 2차원 구조이면서도 표면적이 크게 줄어든 친수성의 Ni-delMWW는 화학 흡착양이 상대적으로 적은 것을 확인하였다. 따라서, 본 연구를 통해 3차원 구조이면서 세공크기가 크고 골격 구조 내 니켈이 치환된 Ni-BEA가 가장 우수한 BTX 흡착성능을 나타내었으며, Ni 이외의 다른 금속 원소를 치환시킨 *BEA 계열 분자체에 대해 건식 및 습식 조건에서의 BTX 흡착에 대한 추가 연구를 수행할 예정이다.
Acknowledgments
본 연구는 대한민국 산업통상자원부의 지원으로 수행한 “고성성 저비용 VOC 저온 산화촉매 시스템 개발” 사업(20005342)의 지원으로 수행되었습니다.
References
-
J. H. Lee, H. Jang, J. H. Park, J. K. Suh, T. S. Chang and I. Heo, “Ceria Based Catalysts for Low Temperature Benzene Oxidation,” Transactions of KSAE, Vol.27, No.6, pp.435-439, 2019.
[https://doi.org/10.7467/KSAE.2019.27.6.435]

-
S. P. Jung and P. G. Lee, “Analysis of PM10 Level Fine Dust Content Rate According to Braking Conditions of an Automotive Disc Brake System,” Transactions of KSAE, Vol.8, No.7, pp.445-452, 2020.
[https://doi.org/10.7467/KSAE.2020.28.7.445]

- National Air Pollutants Emission Service, Emissions by sector, http://airemiss.nier.go.kr/module/statistics/causeStatistics.do?siteId=airemiss&id=airemiss_030300000000, .
-
P. Wee Kong, Y. Rozita and A. M. Kheireddine, “A Review on Activated Carbon Adsorption for Volatile Organic Compounds (VOCs),” Review of Chemical Engineering, Vol.35, pp.649-668, 2019.
[https://doi.org/10.1515/revce-2017-0057]

-
L. Zhu, D. Shen and K. H. Luo, “A Critical Review on VOCs Adsorption by Different Porous Materials: Species, Mechanisms, Modification Methods,” Journal of Hazardous Materials, Vol.389, pp.1220102-1220128, 2020.
[https://doi.org/10.1016/j.jhazmat.2020.122102]

-
M. J. Lashaki, J. D. Atkinson, Z. Hashisho, J. H. Philips, J. E. Anderson and M. Nichols, “The Role of Beaded Activated Carbon’s Pore Size Distribution on Heel Formation during Cyclic Adsorption/Desorption of Organic Vapors,” Journal of Hazardous Materials, Vol.315, No.5, pp.42-51, 2016.
[https://doi.org/10.1016/j.jhazmat.2016.04.071]

-
J. Wang, W. -Q. Wang, Z. Hao, G. Wang, Y. Li, J. -G. Chen, M. Li, J. Cheng and Z. -T. Liu, “A Superhydrophobic Hyper-Cross-Linked Polymer Synthesized at Room Temperature Used as an Efficient Adsorbent for Volatile Organic Compounds,” RSC Advances, Vol.6, pp.97048-97054, 2016.
[https://doi.org/10.1039/C6RA18687D]

-
X. Li, L. Zhang, Z. Yang, P. Wang, Y. Yan and J. Ran, “Adsorption Materials for Volatile Organic Compounds (VOCs) and the Key Factors for VOCs Adsorption Process: A Review,” Separation and Purification Technology, Vol.235, pp.116213-116228, 2020.
[https://doi.org/10.1016/j.seppur.2019.116213]

-
M. Kraus, U. Trommler, F. Holzer, F. -D. Kopinke and U. Roland, “Competing Adsorption of Toluene and Water on Various Zeolites,” Chemical Engineering Journal, Vol.351, pp.356-363, 2018.
[https://doi.org/10.1016/j.cej.2018.06.128]

-
N. Brodu, S. Sochard, C. Andriantsiferana, J. -S. Pic and M. -H. Manero, “Fixed-Bed Adsorption of Toluene on High Silica Zeolites: Experiments and Mathematical Modelling Using LDF Approximation and a Multisite Model,” Environmental Technology, Vol.36, pp.1807-1818, 2015.
[https://doi.org/10.1080/09593330.2015.1012181]

-
S. K. P. Veerapandian, N. de Geyter, J. -M. Giraudon, J. -F. Lamonier and R. Morent, “The Use of Zeolites for VOCs Abatement by Combining Non-Thermal Plasma, Adsorption, and/or Catalysis: A Review,” Catalysts, Vol.9, pp.98-137, 2019.
[https://doi.org/10.3390/catal9010098]

-
W. Wang, H. Wang, T. Zhu and X. Fan, “Removal of Gas Phase Low-Concentration Toluene over Mn, Ag and Ce Modified HZSM-5 Catlaysts by Periodical Operation of Adsorption and Non-Thermal Plasma Regeneration,” Journal of Hazardous Materials, Vol.292, pp.70-78, 2015.
[https://doi.org/10.1016/j.jhazmat.2015.03.013]

-
R. M. Serra, E. E. Miró, P. Bolcatto and A. V. Boix, “Experimental and Theoretical Studies about the Adsorption of Toluene on ZSM5 and Mordenite Zeolites Modified with Cs,” Microporous and Mesoporous Materials, Vol.147, pp.17-29, 2012.
[https://doi.org/10.1016/j.micromeso.2011.05.016]

-
C. Reichardt and T. Welton, Solvents and Solvent Effects in Organic Chemistry, Wiley-VCH, Weinheim, pp.549-586, 2011.
[https://doi.org/10.1002/9783527632220]

-
D. P. Serrano, G. Calleja, J. A. Botas and F. J. Gutierrez, “Characterization of Adsorptive and Hydrophobic Properties of Silicate-1, ZSM-5, TS-1 and Beta Zeolites by TPD Techniques,” Separation and Purification Technology, Vol.54, pp.1-9, 2007.
[https://doi.org/10.1016/j.seppur.2006.08.013]

-
H. Gao, L. Hu, Y. Hu, X. Lv, Y. -B. Wu and G. Lu, “Origins of Lewis Acid Acceleration in Nickel-Catalysed C-H, C-C and C-O Bond Cleavage,” Catalysis Science & Technology, Vol.11, pp.4417-4428, 2021.
[https://doi.org/10.1039/D1CY00660F]

-
A. Corma, C. Corell and J. Pérez-Pariente, “Synthesis and Characterization of the MCM-22 Zeolite,” Zeolites, Vol.15, pp.2-8, 1995.
[https://doi.org/10.1016/0144-2449(94)00013-I]

-
R. Millini, G. Perego, W. O. Parker Jr., G. Bellusi and L. Carluccio, “Layered Structure of ERB-1 Microporous Borosilicate Precursor and Its Intercalation Properties Towards Polar Molecules,” Microporous Materials, Vol.4, No.2, pp.221-230, 1995.
[https://doi.org/10.1016/0927-6513(95)00013-Y]

-
A. Corma, V. Fornes, S. B. Pergher, Th. L. M. Maesen and J. G. Buglass, “Delaminated Zeolite Precursors as Selective Acidic Catalysts,” Nature, Vol.396, pp.353-356, 1998.
[https://doi.org/10.1038/24592]

-
H. -K. Min, S. Kweon, Y. W. Kim, H. An, D. Jo, E. D. Park, C. -H. Shin and M. B. Park, “Atomically dispersed nickel species in a Two-Dimensional Molecular Sieve: Origin of High Activity and Stability in Dry Reforming of Methane,” Applied Catalysis B: Environmental, Vol.298, pp.120627-120636, 2021.
[https://doi.org/10.1016/j.apcatb.2021.120627]

-
Z. Zhu, H. Xu, B. Wang, J. Yin, J. Jiang, H. Lü and P. Wu, “Intensified Interzeolite Transformation: Ultrafast Synthesis of Active and Stable Ti-Beta Zeolites without Solvents,” Chemical Communications, Vol.55, pp.14279-14282, 2019.
[https://doi.org/10.1039/C9CC07423F]

-
A. Schwanke, J. Villarroel-Rocha, K. Sapag, U. Díazm, A. Corma and S. Pergher, “Dandelion-like Microspherical MCM-22 Zeolite Using BP 2,000 as a Hard Template,” ACS Omega, Vol.3, pp.6217-6223, 2018.
[https://doi.org/10.1021/acsomega.8b00647]

-
J. Li, H. Liu, T. An, Y. Yue and X. Bao, “Carboxylic Acids to Butyl Esters over Dealuminated-Realuminated Beta Zeolites for Removing Organic Acids from Bio-Oils,” RSC Advances, Vol.7, pp.33714-33725, 2017.
[https://doi.org/10.1039/C7RA05298G]

-
M. Marosz, B. Samojeden, A. Kowalczyk, M. Ruthowska, M. Motak, U. Díaz, A. E. Palomares and L. Chmielarz, “MCM-22, MCM-36, and ITQ-2 Zeolites with Different Si/Al Molar Ratios as Effective Catalysts of Methanol and Ethanol Dehydration,” Materials, Vol.13, No.10, pp.2399-2415, 2020.
[https://doi.org/10.3390/ma13102399]

-
Q. Q. Wang, J. Qu, Y. Liu, C. X. Gui, S. M. Hao, Y. Yu and Z. Z. Yu, “Growth of Nickel Silicate Nanoplates on Reduced Graphene Oxide as Layered Nanocomposites for Highly Reversible Lithium Storage,” Nanoscale, Vol.7, pp.16805-16811, 2015.
[https://doi.org/10.1039/C5NR05719A]