일산화탄소를 활용한 선택적 촉매 환원법에서 이리듐 촉매의 제올라이트 지지체에 따른 질소산화물 저감 효과 연구
 ; Dong Won Lee2) ; Youngwoo You2) ; Iljeong Heo2) ; Jin Hee Lee2)
; Dong Won Lee2) ; Youngwoo You2) ; Iljeong Heo2) ; Jin Hee Lee2)
Copyright Ⓒ 2020 KSAE / 173-07
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium provided the original work is properly cited.
Abstract
Among the technologies for removing nitrogen oxide(NOx), which is known as a secondary-particulate-matter-inducing precursor, selective catalytic reduction by NH3(NH3-SCR) applied to car waste gas treatment has a disadvantage of supplying NH3 by converting urea; thus, an alternative technology is required. Carbon monoxide(CO) is considered a good alternative because it can be easily supplied from fuels, directly from swept gas or through the engine technology. The CO-SCR technology has been studied in a limited range, and in particular, despite the use of zeolites as NH3-SCR commercial catalysts, CO-SCR studies using these zeolites as support are hardly reported. In this study, CO-SCR catalysts were synthesized by impregnating iridium into various types of zeolite support, and the NOx conversion was evaluated according to the type of support. The synthesized catalysts were characterized via PXRD, TEM, N2 sorption, and H2 chemisorption.
Keywords:
Particulate matter, NOx, SCR, Support materials, Zeolite키워드:
미세먼지, 질소산화물, 선택적촉매환원반응, 지지체, 제올라이트1. 서 론
최근 미세먼지에 대한 유해성, 심각성이 국내외 모두에서 사회적으로 중요한 이슈가 되고 있으며, 자동차와 같은 이동원 및 화력발전소와 같은 고정원에서 발생하는 질소산화물(NOx)은 미세먼지의 대표적 전구체 중 하나로 알려져 있다.1,2) NOx를 제거하기 위한 기술 중 선택적 촉매 환원법(Selective catalytic reduction, SCR)이 가장 잘 알려져 있으며, 특히 암모니아(NH3)를 환원제로 사용하는 NH3-SCR 기술은 현재 상용화되어 디젤 차량 등에 적용되어있다.3) 하지만, 자동차 베기가스 처리에 적용되어 있는 NH3-SCR 기술은 요소(Urea, NH2CONH2)를 변환시켜 NH3를 공급해야 하는 단점 등을 가지고 있어 이에 대한 대안 기술이 요구되고 있다.
NH3를 대체할 수 있는 환원제 중에는 다양한 탄화수소화합물(Hydrocarbons, HC-SCR), 수소(H2-SCR), 일산화탄소(CO-SCR) 등이 있으며, 이 중 CO는 베기가스에서 직접 또는 엔진기술에 의해 연료로부터 쉽게 공급이 가능하여 CO-SCR 기술은 좋은 대안으로 여겨지고 있다.4) CO를 환원제로 사용하는 SCR 촉매반응에는 주로 백금족 원소가 높은 활성을 보이는 것으로 알려져 있으며, 그 중 특히 이리듐(Ir)이 높은 NOx 전환효율을 나타내는 것으로 알려져 있다.4-12) 알루미나(Al2O3)를 지지체로 하는 Ir 촉매반응에서 촉매 활성점에 NO 분자의 분포가 O2에 비해 더 높은 것으로 보고되어 있으며, 이는 CO에 의한 NO의 선택적 환원이 가능한 이유 중 하나로 유추해 볼 수 있다.5) 반응 조건에 따라 0.02 - 5 wt%의 Ir이 함유된 Al2O3, SiO2, Silicalite, WO3, Nb2O5, Ta2O5, TiO2, ZSM-5 등의 지지체에 따른 CO-SCR 반응결과가 보고되어 있으며,6-13) 지지체의 종류가 반응 결과에 큰 영향을 미치는 것을 확인할 수 있다.
하지만, NH3, 탄화수소화합물, 등 다른 환원제를 사용하는 연구에 비해 CO-SCR 기술은 가장 제한적인 범위에서 연구되어 있으며, 그 이유 중 하나는 O2의 농도가 높은 조건에서는 CO가 NOx와 반응하여 환원제로 사용되기 보다는 O2와 반응하여 먼저 소비되는 현상이 발생하기 때문이다. 한편, 다른 환원제로 사용하는 기술들에서는 촉매구성에 제올라이트를 지지체로 사용한 연구결과들이 다수 보고되어 있고, 특히, NH3-SCR은 상용촉매로 제올라이트가 사용되고 있음에도 불구하고, 이들 나노다공성 소재를 지지체로 사용하는 CO-SCR 연구는 거의 보고되어 있지 않다. 따라서, 본 연구에서는 제올라이트 지지체에 따른 Ir 촉매의 CO-SCR 반응에 대한 연구를 수행하였다.
2. 실험 방법
2.1 촉매 합성
서로 다른 구조적 특징을 갖는 총 5종의 대표적 상용 제올라이트(NH4-beta(구조코드 *BEA), H-mordenite(MOR), NH4-ZSM-5(MFI), NaK-ferrierite(FER), NH4-SSZ-13(CHA))와 비교를 위해 Silica(SiO2), γ-alumina(Al2O3) 지지체를 준비하였다. 제올라이트 지지체는 양이온에 의한 효과를 배제하기 위해 모두 H+ 이온 형태인 H-form으로 만들었다. NH4-form 제올라이트는 550 °C 공기분위기 조건에서 2 시간 소성을 통해 H-form으로 변화시켰다. NaK-form의 경우 1.0 M NH4NO3 용액 80 °C에서 6시간 이온 교환을 2회 실시 후, 앞서 언급한 동일한 방법을 통해 H-form으로 만들었다. 준비한 지지체에 IrCl3・xH2O 전구체 수용액을 사용한 초기 습식 합침법(Incipient wetness impregnation)으로 4 wt%의 Ir을 함유시켰으며, 습식 소성법(0.01 cc/min의 증류수를 도입한 500 °C 30 cc/min의 공기 흐름 조건에서 4 시간 소성)을 통해 Ir/지지체 촉매를 합성하였다. Ir 함량 변화 따른 촉매 특성을 알아보기 위해 H-ZSM-5 지지체에 한해 0.5 - 4 wt%의 Ir/H-ZSM-5 촉매를 합성하였다.
2.2 촉매 특성분석
합성한 촉매의 Powder X-ray diffraction(PXRD) 패턴은 Rigaku SmartLab 분석기를 사용해 40 kV, 30 mA에서 가속시킨 Cu Kα 복사선으로 측정하였다. Transmission electron microscope(TEM) 이미지는 Thermo Scientific Talos F200X 분석기를 사용해 200 kV로 가속시킨 전자빔으로 얻었다. N2 흡탈착 분석에 의한 표면적 계산은 Micromeritics Tirstar II 분석기를 사용하여 측정하였다. H2를 탐침 분자로 사용한 화합흡착 분석은 Micromeritics사의 분석기를 사용하였으며, 흡착 전 H2 분위기에서 전처리를 하여 소성 과정 중 산화된 IrOx를 Ir으로 환원시킨 후 Ir 입자의 크기와 분포를 측정하였다. 촉매의 표면적과 화학흡착 분석 결과는 Table 1에 정리하였다.
2.3 촉매 반응
CO-SCR 반응은 직접 제작한 연속 고정층 촉매반응장치에서 수행하였다. 180 ~ 250 μm의 균일한 입자크기를 갖는 촉매 0.2 g을 고정층에 두고 5% H2/Ar balance 800 cc/min 흐름과 500 °C(5 °C/min 승온) 조건에서 20분 간 전처리하였다. 전처리 후 첫 번째 반응 온도까지 온도를 낮추고 반응 혼합물 가스(50 ~ 300 ppm NO, 0.1 또는 0.7 % CO, 5 % O2/N2 balance 500 cc/min, GHSV = 100000 h-1)를 주입시켜 반응을 시작하였다. 반응온도는 150 ~ 600 °C로 증가시켰으며, 한 온도에서의 반응은 30분간 진행하였다. 반응 후 CO, NO, NO2, N2O, 등 가스 농도는 Nicolet iS10 FT-IR 가스 분석기를 이용하여 확인하였다.
3. 결과 및 토론
3.1 촉매 특성분석
준비한 7종의 Ir/지지체 촉매에 대한 PXRD 분석결과를 Fig. 1에 나타내었다. 습식 소성 후에도 제올라이트 지지체의 결정 구조는 그대로 유지되었으나, 2θ = 28°과 34° 근처에서 각각 매우 낮은 세기를 갖는 IrO2 (110), (101) X-ray 피크가 새롭게 관찰되는 것을 확인하였다.4) 대표 시료로써 상대적으로 가장 큰 세기를 보이는 Ir/H-beta XRD 패턴의 IrO2 (101) X-ray 피크로부터 Scherrer 식을 적용하여 IrO2의 입자크기를 계산해 보았을 때, 약 14 nm로 유추할 수 있다. 이로부터 습식 소성 이후에 IrO2 입자 중 일부가 제올라이트 외부 표면에 분산 되어 있음을 알 수 있다. H-ZSM-5 시료에 대해 Ir 함량을 0.5 - 4 wt%로 증가시켜 보았지만, IrO2 (110), (101) X-ray 피크의 세기는 큰 변화가 없는 것을 확인하였다. 또한, 습식 소성 후 촉매 시료에 대한 N2 흡탈착 분석 결과(Table 2), 제올라이트 지지체 촉매의 경우 Ir 함침 전 시료에 비해 BET 표면적이 약 20 ~ 40 % 감소하였으며, 이는 세공 내 함침된 Ir에 의한 결과로 볼 수 있다. 표면적이 감소하였지만, 여전히 세공 특성을 유지하고 있음을 확인할 수 있다.
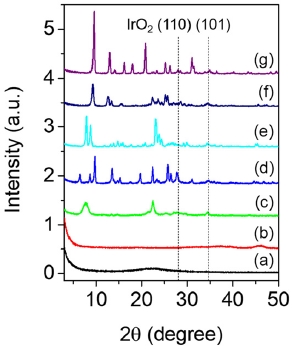
Powder XRD patterns of (a) Ir/SiO2, (b) Ir/Al2O3, (c) Ir/H-beta, (d) Ir/H-mordenite, (e) Ir/H-ZSM-5, (f) Ir/H-ferrierite and (g) Ir/H-SSZ-13
Fig. 2는 습식 소성 후 Ir 함침 촉매 시료에 대한 TEM 분석 결과를 보여준다. 단축의 길이가 약 10 nm 정도의 비교적 균일한 크기를 갖는 Rod 형태의 IrO2 입자를 확인할 수 있다. 이는 전형적인 IrO2 입자의 형태로써,4) PXRD 결과로부터 유추한 IrO2 입자의 크기와도 잘 일치한다.

TEM images of (a) Ir/SiO2, (b) Ir/Al2O3, (c) Ir/H-beta, (d) Ir/H-mordenite, (e) Ir/H-ZSM-5, (f) Ir/H-ferrierite and (g) Ir/H-SSZ-13
Ir/H-ZSM-5의 경우 Ir의 함량이 증가하여도 IrO2 입자의 크기에는 큰 변화가 없었으며, 이 역시 PXRD 분석 결과와 잘 일치한다. 한편 H2 전처리에 의한 IrO2의 환원 후 H2를 탐침 분자로 사용한 화학흡착 분석 결과를 보면(Table 2), Ir/제올라이트 촉매의 Ir 입자의 분포는 10.2 ~ 12.4 %, 크기는 11.8 ~ 14.3 nm로 비교적 균일한 것을 알 수 있다. Ir 입자의 경우 PXRD 패턴으로부터 계산한 IrO2 입자의 크기와 유사한 범위의 크기를 나타내는 것을 확인할 수 있다.
3.2 CO-SCR 반응
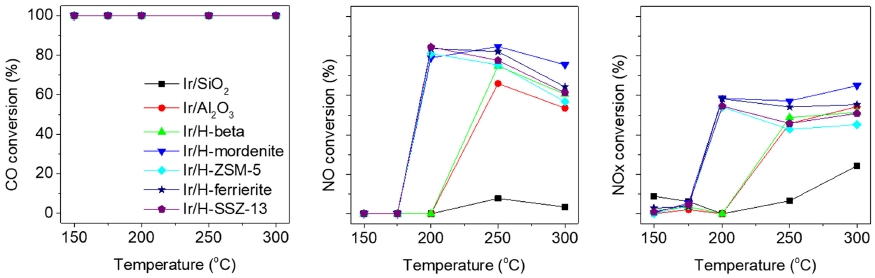
Fig. 3은 300 ppm의 NO, 0.1 %의 CO, 5 %의 O2를 함유한 반응물 가스를 주입하여 250 ~ 600 °C의 온도 영역에서의 Ir/지지체 촉매에 대한 CO-SCR 반응 결과를 보여준다. 비교군으로 사용한 Ir/SiO2를 제외하고 모든 제올라이트 지지체 촉매에 대해 거의 100 %의 CO 전환율을 나타내었다. 특히 250 °C의 저온 영역에서 Ir/H-SSZ-13 촉매가 가장 높은 NO 전환율을 나타내었다. 모든 반응에 대해 N2O는 거의 생성되지 않았지만, 고온 영역에서는 대부분의 촉매가 높은 NO2 선택도를 보였으며, 이로부터 NOx의 전환율은 낮은 것을 확인할 수 있다. 이와 같은 결과는 반응물 중 낮은 CO의 비율 때문으로 미반응한 NO의 산화에 의한 결과로 볼 수 있다.
CO (left) and NO (middle) conversion, and NO2 selectivity (right) as a function of reaction temperature over Ir/support catalysts. Feed composition: 300 ppm NO, 0.1 % CO, 5 % O2 and N2 balance (100000 h-1 GHSV)
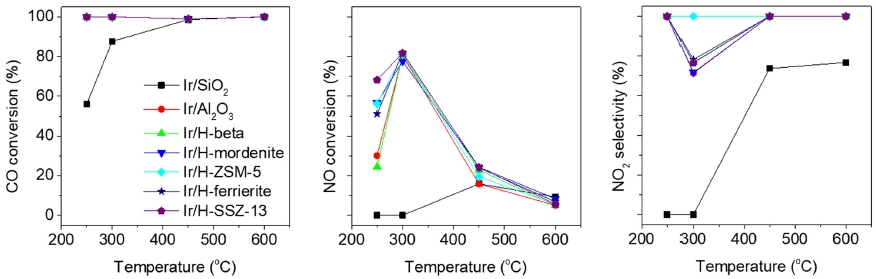
Fig. 4는 앞선 반응에 비해 상대적으로 높은 CO의 농도를 갖는 반응물(100 ppm NO, 0.7 % CO, 5 % O2)을 주입하여 온도 변화에 따른 CO-SCR 결과를 보여 준다. 특히, 300 °C 미만의 저온 영역에서의 촉매 간 반응 특성을 비교하기 위한 연구를 수행 하였다. Ir/SiO2, Ir/Al2O3를 포함한 모든 촉매에 대해 100 %의 CO 전환율을 나타내었다. 모든 반응에 대해 N2O는 거의 생성되지 않았으며, 예상대로 상대적으로 높은 CO의 조성으로 NO의 산화반응이 억제되어 높은 NOx 전환율을 나타내었다. 일반적인 SiO2, Al2O3 지지체 촉매에 비해 제올라이트 지지체 Ir 촉매의 활성이 대체적으로 높은 것을 확인할 수 있으며, 제올라이트 지지체 촉매 중에서는 Ir/H-mordenite의 성능이 가장 좋았다. 따라서 제올라이트 지지체 구조에 따라 CO-SCR 성능이 달라지는 것을 확인할 수 있다.
4. 결 론
본 연구에서는 대표적 세공 특성을 갖는 다섯 종의 제올라이트 지지체(*BEA, MOR, MFI, FER, CHA)에 4 wt%의 Ir 금속을 함침시켜 CO-SCR 촉매를 합성하고, 지지체의 종류에 따른 NOx 전환 효율을 평가하였다. 합성한 촉매의 PXRD, TEM 분석을 통해 Ir 함침에 의한 촉매 합성 후에도 제올라이트 구조체는 유지되지만, 10 nm 이상의 크기를 갖는 IrO2 입자가 제올라이트 지지체 표면에 존재하는 것을 확인하였다. 합성한 촉매를 H2 환원 처리 후 측정한 H2 화학흡착 분석에서도 비슷한 크기의 Ir 입자가 제올라이트 지지체 표면에 존재하지만 분포는 11 %정도 이고, N2 흡탈착 분석을 통해 지지체 자체의 표면적보다 20 ~ 40 % 정도 감소한 결과로부터, 세공 내에 Ir이 함침 되었음을 유추할 수 있었다. CO의 농도가 낮은 조건에서는 250 °C의 저온 영역에서 Ir/H-SSZ-13 촉매가 가장 높은 NO 전환율을 나타내었지만, 고온영역에서는 모든 촉매에 대해 낮은 NOx 전환율을 보였는데, 이는 낮은 CO의 농도로 미반응한 NO의 산화에 의한 결과로 해석하였다. 상대적으로 CO의 농도가 높은 조건에서는 NO의 산화반응이 억제되어 높은 NOx 전환율을 보였으며, 특히 Ir/H-mordenite의 전환율이 가장 높은 것을 확인하였다. 제올라이트 지지체 촉매가 반응조건에 관계없이 일반적 지지체인 SiO2, Al2O3에 비해 더 높은 CO-SCR 성능을 나타내는 것을 확인할 수 있었으며, 알칼리금속, 황, 수분, 등의 영향에 대한 추가 연구를 수행할 계획이다.
Acknowledgments
본 연구는 한국화학연구원에서 수행하는 “질소산화물 저감을 위한 요소수무활용 신개념 촉매 원천기술 개발” 사업(SI1913-20)과 대한민국 산업통상자원부의 지원으로 수행한 “고성능 저비용 VOC 저온 산화촉매 시스템 개발” 사업(20005342)의 협력연구로 수행되었습니다.
References
-
Q. Schiermeier, The Science Behind the Volkswagen Emissions Scandal, Nature News, Sep. 24, 2015.
[https://doi.org/10.1038/nature.2015.18426]

-
B. Lee, B. Yun, J. Jung, D. Kim, W. Cha, S. Lee and I. Kim, “Study on NOx Emission Characteristics of Diesel Light Duty Vehicles by Analyzing Massive Driving Data,” Transactions of KSAE, Vol.26, No.5, pp.684-692, 2018.
[https://doi.org/10.7467/KSAE.2018.26.5.684]

-
S. Moon, N. Jo, S. Oh, S. Jeong and K. Park, “A Numerical Study on the Optimization of Urea Solution Injection to Maximize Conversion Efficiency of NH3,” Transactions of KSAE, Vol.22, No.3, pp.171-178, 2014.
[https://doi.org/10.7467/KSAE.2014.22.3.171]

-
H. Hamada and M. Haneda, “A Review of Selective Catalytic Reduction of Nitrogen Oxides with Hydrogen and Carbon Monoxide,” Applied Catalysis A: General, Vols.421-422, pp.1-13, 2012.
[https://doi.org/10.1016/j.apcata.2012.02.005]

-
S. J. Tauster and L. L. Murrell, “The NO-CO Reaction in the Presence of Excess O2 as Catalyzed by Iridium,” Journal of Catalysis, Vol.41, Issue 1, pp.192-195, 1976.
[https://doi.org/10.1016/0021-9517(76)90216-5]

-
T. Yoshimari, K. Sato, M. Haneda, Y. Kintaichi and H. Hamada, “Remarkable Promoting Effect of Coexisting SO2 on the Catalytic Activity of Ir/SiO2 for NO Reduction in the Presence of Oxygen,” Catalysis Communications, Vol.2, Issue 5, pp.155-158, 2001.
[https://doi.org/10.1016/S1566-7367(01)00025-5]

-
T. Yoshinari, K. Sato, M. Haneda, Y. Kintaichi and H. Hamada, “Positive Effect of Coexisting SO2 on the Activity of Supported Iridium Catalysts for NO Reduction in the Presence of Oxygen,” Applied Catalysis B: Environmental, Vol.41, Issues 1-2, pp.157-169, 2003.
[https://doi.org/10.1016/S0926-3373(02)00208-4]

-
M. Haneda, T. Yoshinari, K. Sato, Y. Kintaichi and H. Hamada, “Ir/SiO2 as a Highly Active Catalyst for the Selective Reduction of NO with CO in the Presence of O2 and SO2,” Chemical Communications, pp.2814-2815, 2003.
[https://doi.org/10.1039/b309981d]

-
A. Wang, L. Ma, Y. Cong, T. Zhang and D. Liang, “Unique Properties of Ir/ZSM-5 Catalyst for NO Reduction with CO in the Presence of Excess Oxygen,” Applied Catalysis B: Environmental, Vol.40, pp.319-329, 2003.
[https://doi.org/10.1016/S0926-3373(02)00157-1]

-
M. Shimokawabe and N. Umeda, “Selective Catalytic Reduction of NO by CO over Supported Iridium and Rhodium Catalysts,” Chemistry Letters, Vol.33, No.5, pp.534-535, 2004.
[https://doi.org/10.1246/cl.2004.534]

-
M. Haneda, Pusparatu, Y. Kintaichi, I. Nakamura, M. Sasaki, T. Fujitani and H. Hamada, “Promotional Effect of SO2 on the Activity of Ir/SiO2 for NO Reduction with CO under Oxygen-Rich Conditions,” Journal of Catalysis, Vol.229, Issue 1, pp.197-205, 2005.
[https://doi.org/10.1016/j.jcat.2004.10.022]

-
H. Inomato, M. Shimokawabe, A. Kuwana and M. Arai, “Selective Reduction of NO with CO in the Presence of O2 with Ir/WO3 Catalysts: Influence of Preparation Variables on the Catalytic Performance,” Applied Catalysis B: Environmental, Vol.84, Issues 3-4, pp.783-789, 2008.
[https://doi.org/10.1016/j.apcatb.2008.06.011]

-
M. Haneda and H. Hamada, “Promotional Role of H2O in the Selective Catalytic Reduction of NO with CO over Ir/WO3/SiO2 Catalyst,” Journal of Catalysis, Vol.273, Issue 1, pp.39-49, 2010.
[https://doi.org/10.1016/j.jcat.2010.04.021]